LABORATORIOS
Laboratorio de Reprogramación neuronal directa
Grupo de Reprogramación neuronal
Investigación
Personal
Publicaciones
Contacto
Otros
Investigación

Líneas de investigación
1) Uso de la hipotermia para favorecer la reprogramación de células gliales a neuronas inducidas
En un estudio previo demostramos que existe una barrera metabólica que impide la reprogramación de diversos tipos celulares a neuronas (Gascón et al., 2016, 2017). Ésta barrera tiene su origen en la transición metabólica, desde la glicolisis a la fosforilación oxidativa, que las células experimentan durante la conversión neuronal, y que conlleva a la formación de radicales libres de oxígeno y a la muerte de las células por ferroptosis.
La hipótesis de partida de este proyecto es que la reducción de la velocidad a la que suceden las reacciones químicas durante la reprogramación neuronal, inducida por hipotermia, aporta el tiempo necesario para que las células se adapten a la nueva identidad metabólica, lo que disminuye la aparición de radicales libres de oxígeno. Nuestros datos indican que, en condiciones de hipotermia, diversos tipos de células gliales en cultivo pueden ser reprogramados a neuronas más eficientemente. El objetivo final de esta línea de trabajo es aplicar la hipotermia en modelos de reprogramación neuronal in vivo para aumentar la eficiencia
de las terapias basadas en la sustitución celular.
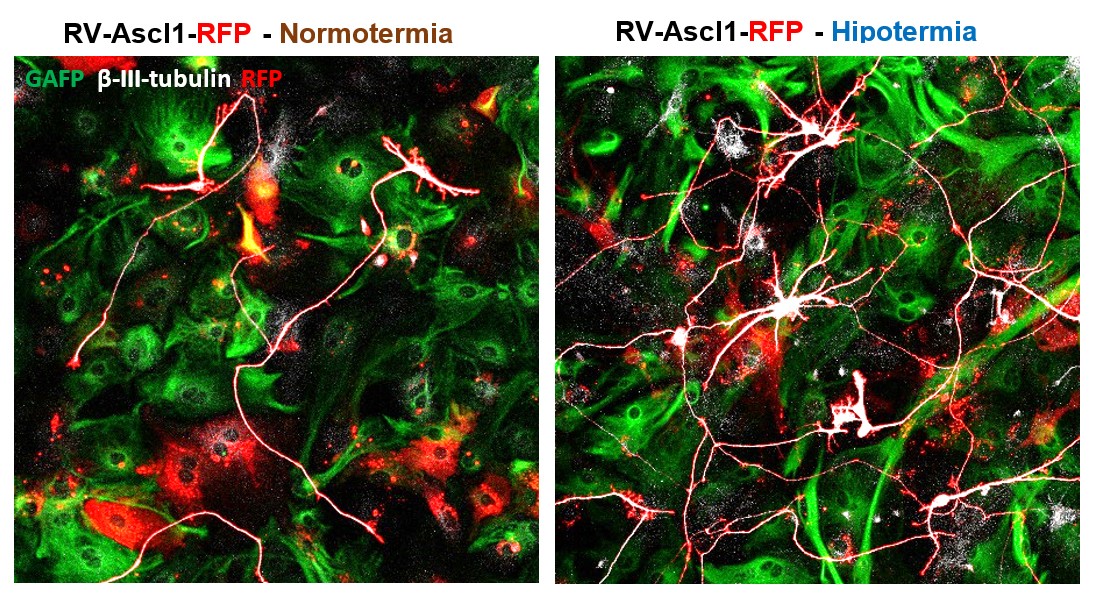
La imagen de la izquierda muestra iNs derivadas de astrocitos de ratón reprogramados en condiciones de normotermia,
mientras que la figura de la derecha muestra células reprogramadas en condiciones de hipotermia.
2) Identificación de barreras epigenéticas que dificultan la obtención de subtipos de iNs específicos.
Uno de los mayores desafíos en el campo de la reprogramación neuronal directa es la generación de todos los subtipos de neuronas que componen el cerebro. Esto es excepcionalmente complejo debido a la amplia variedad de subtipos neuronales existentes y a la falta de conocimiento de los programas transcriptómicos que determinan la adquisición de identidades neuronales específicas. En este sentido, se piensa que los cambios epigenéticos que tienen lugar durante la diferenciación neuronal podrían ser determinantes tanto para la adquisición de identidades neuronales específicas como para prevenir que distintos subtipos neuronales, ya establecidos, reviertan su identidad de forma espontánea. Esta hipótesis está respaldada por el hecho de que, mientras que las neuronas jóvenes o los neuroblastos pueden reprogramarse a subtipos neuronales alternativos en respuesta a la sobreexpresión de ciertos genes selectores de linaje, no se conoce ninguna estrategia para cambiar la identidad de las neuronas una vez que estas son maduras. Aunque estas restricciones epigenéticas sean fundamentales para el correcto desarrollo y funcionamiento del cerebro, resultan un obstáculo importante en la obtención de iNs que pertenezcan a subpoblaciones neuronales de interés para la comunidad científica, y que puedan ser relevantes en terapias regenerativas basadas en sustitución celular. Por lo tanto, esta línea de investigación pretende descubrir nuevos mecanismos epigenéticos que subyacen a la especificación de subtipos neuronales, en modelos de neurogénesis y reprogramación neuronal en el cerebro adulto para avanzar en la comprensión de las bases moleculares que regulan estos procesos.
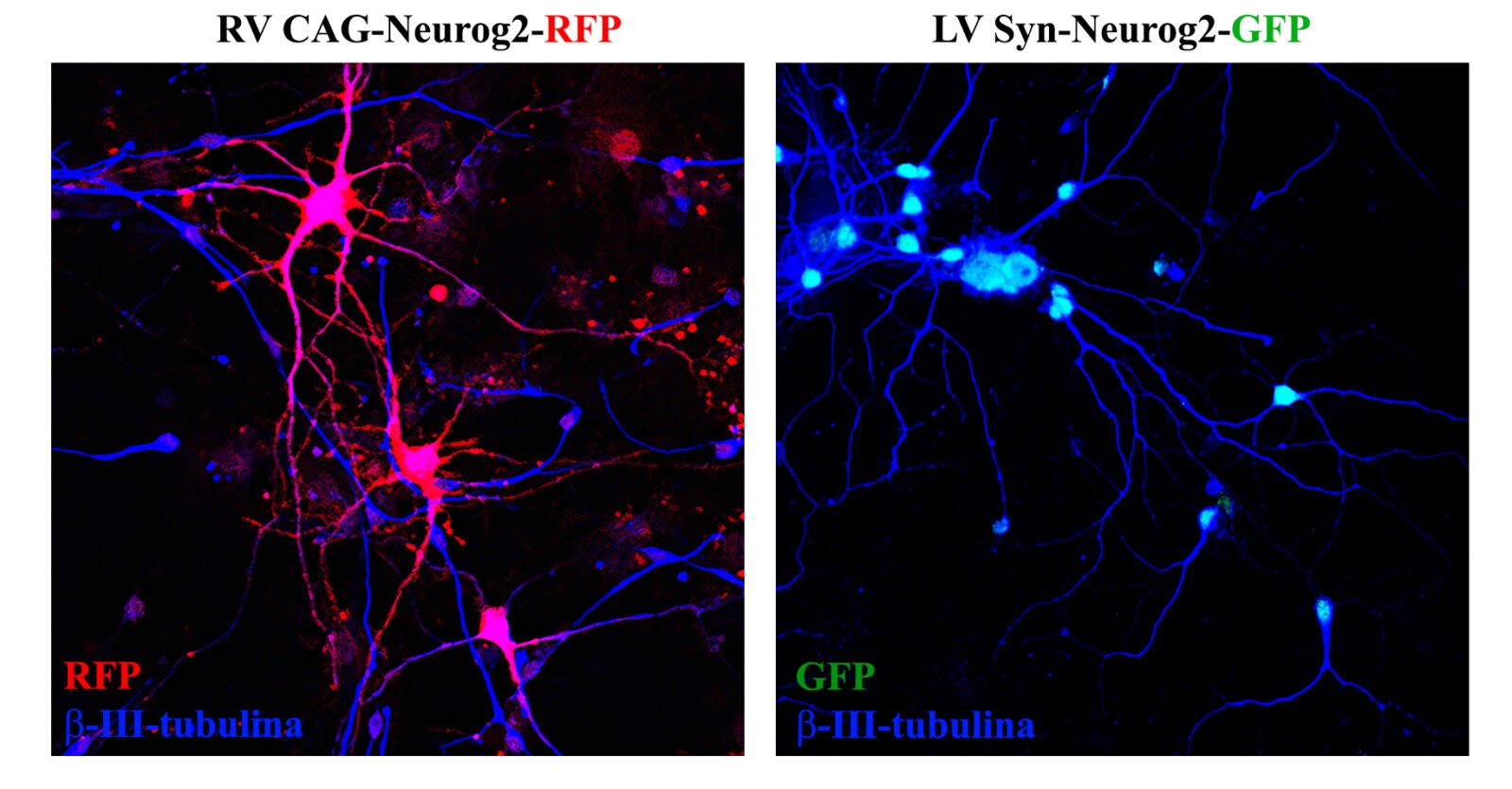
A la izquierda se muestran células derivadas de la zona subventricular de ratón (originalmente de linaje
GABAérgico), reespecificadas a neuronas glutamatérgicas (nótese el soma amplio y la gran complejidad
dendrítica) por la expresión retroviral del factor neurogénico Neurog2. A la derecha puede verse que la
expresión lentiviral del mismo factor no tiene efecto en neuronas GABAérgicas ya diferenciadas.
3) Reprogramación neuronal directa para el estudio de enfermedades neurodegenerativas.
En las últimas décadas, las iPSCs han sido el material de partida más apropiado para obtener y estudiar distintos tipos de células humanas in vitro. Sin embargo, la adquisición de la pluripotencia conlleva al rejuvenecimiento de las células, lo que dificulta el estudio de las correlaciones moleculares y/o celulares entre las enfermedades neurodegenerativas y el proceso del envejecimiento celular. Para solucionarlo, una alternativa prometedora es el uso de metodologías basadas en la conversión celular directa, que mantienen la edad inicial de las células reprogramadas.
En nuestro laboratorio utilizamos este enfoque para reprogramar fibroblastos dérmicos humanos a distintos tipos de neuronas y otras células relevantes en enfermedades del SNC como, por ejemplo, neuronas motoras y miotubos del músculo esquelético, dos linajes afectados en la esclerosis lateral amiotrófica (ELA). En este caso, para la reprogramación neuronal utilizamos vectores retrovirales que inducen la expresión de los genes Neurog2, Isl1 y Bcl-2. La combinación estos genes, tanto en fibroblastos control como en aquellos procedentes de pacientes con ELA, da lugar a una población pura de neuronas motoras inducidas (iMNs, β-III-tubulina + , Hb9 + e Isl2 + ). Para la obtención de músculo esquelético, utilizamos una metodología similar, basada en la expresión retroviral del factor miogénico MyoD. En condiciones de cultivo específicas, los miotubos inducidos (iMs) resultan inmunoreactivos para faloidina y miosina, exhiben estructuras sarcoméricas bien definidas y establecen uniones neuromusculares (detectables con bungarotoxina) con las iMNs.
Este tipo de cultivos son una plataforma ideal para el desarrollo de distintos modelos de enfermedades neurodegenerativas, y nuestro equipo los utiliza extensivamente en el estudio de la patología humana.
Ver más información en www.gasconlab.com
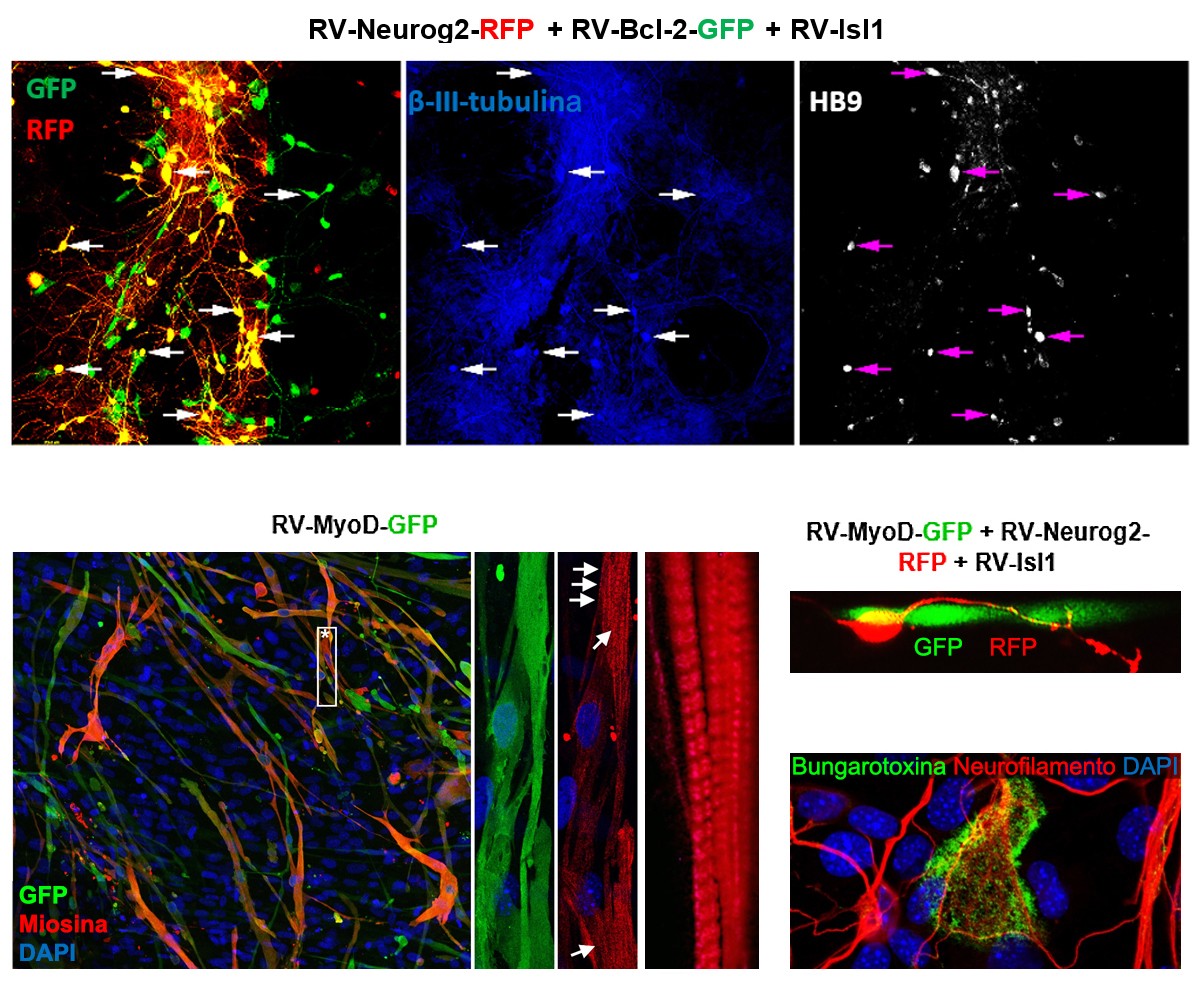
Las imágenes superiores muestran iMNs derivadas de fibroblastos humanos reprogramados. Las
imágenes inferiores muestran iMs en monocultivo (izquierda) o cocultivadas con iMNs (derecha)
derivados de fibroblastos humanos reprogramados. En los cocultivos, se muestra la presencia de
uniones neuromusculares detectadas por bungarotoxina.
Metodología más relevante
1) Desarrollo de cultivos primarios de células de ratón y de líneas humanas, así como su utilización en modelos de reprogramación celular.
2) Métodos de análisis del estado redox celular y de estrés oxidativo durante la reprogramación neuronal.
3) Técnicas de reprogramación neuronal en el cerebro de ratón adulto.
4) Producción y uso de vectores retrovirales para la expresión de proteínas exógenas.
5) Utilización del virus de la rabia para el rastreo sináptico retrógrado.
6) Técnicas de biología molecular y biología celular, como realización de clonajes, inmunocitoquímica, inmunohistoquímica, citometría de flujo y análisis de perfil
transcriptómico en célula única
Personal
Miembros anteriores participantes en proyectos de investigación en curso
Dulce María Arzate
Investigadora postdoctoral
dulce.arzate@cajal.csic.es
Ana Victoria Prádanos Senén
Estudiante de Máster (actualmente estudiante predoctoral)
ana.pradanos@cbm.csic.es
Publicaciones
Publicaciones
Ver también http://www.gasconlab.com/
Patentes:
1. Gascón S and Götz M. Trans-differentiation of differentiated cells. European patent application for anti-oxidant molecules in direct neuronal reprogramming, WO 2015/114059 A1. 2015.
Capítulos de libro:
2. Falco A, Bartolomé-Cabrero R, Gascón Sɸ§. Bcl-2-Assisted Reprogramming of Mouse Astrocytes and Human Fibroblasts into Induced Neurons. Methods Mol Biol. 2021;2352:57- 71. doi: 10.1007/978-1-0716-1601-7_5. PMID: 34324180.
3. Lucía Paniagua-Herranz, Rosa Gómez-Villafuertes, David de Agustín-Durán, Sergio Gascón, Raquel Pérez-Sen, Esmerilda G. Delicado, María Teresa Miras-Portugal, Felipe Ortega. Time-Lapse Video Microscopy and Single Cell Tracking to Study Neural Cell Behavior In Vitro. Methods in Molecular Biology 2020;2150:183-194. doi: 10.1007/7651_2019_219.
Revisiones científicas:
4. Stockwell BR, Friedmann Angeli JP, Bayir H, Bush A, Conrad M, Dixon S, Fulda S, Gascón S, Hatzios S, Kagan V, Noel K, Jiang X, Linkermann A, Murphy M, Overholtzer M, Oyagi A, Pagnussat G, Park J, Prives C, Ran Q, Rosenfeld C, Salnikow K, Tang D, Torti F, Torti S, Toyokuni S, Woerpel K, Zhang D. Ferroptosis: a regulated cell death nexus linking metabolism, redox biology, and disease. Cell. 2017. Oct 5;171(2):273-285. doi: 10.1016/j.cell.2017.09.021.
5. Gascón S*, Masserdotti G*, Russo G*, Götz M. Direct neuronal reprogramming – achievements, hurdles and new roads to success. Cell Stem Cell. 2017 Jul 6;21(1):18-34. doi: 10.1016/j.stem.2017.06.011.
6. Masserdotti G*, Gascón S*, Götz M. Direct neuronal reprogramming-Learning from and for development. Development. 2016 143: 2494-2510; doi: 10.1242/dev.092163.
Artículos originales:
7. Peron S, Brill M, Miyakoshi L, Ortega F, Manzano D, Gascón S§ɸ, Berninger B§ɸ. Programming of neural progenitors of the adult subependymal zone towards a glutamatergic identity by Neurog2. (Stem Cell Reports (IF7.8), in advanced revision). Preliminary version already published at:
http://www.biorxiv.org/content/early/2017/08/03/171686.full.pdf+html
8. Karakatsani A, Marichal N*, Urban, S*, Kalamakis G, Schick A, Zhang Y, Ghanem A, Zhang, Y., Conzelmann K, Rüegg MA, Berninger B, Ruiz de Almodovar C, Gascón S, Kröger. Neuronal LRP4 Regulates Synapse Formation in the Developing CNS. Development. 2017 Oct 23. pii: dev.150110. doi: 10.1242/dev.150110.
9. Gómez-Villafuertes R*, Paniagua-Herranz L*, Gascón S*, Agustín-Durán D, Ferreras M, Gil-Redondo JC, Queipo MJ, Menendez-Mendez A, Pérez-Sen R, Delicado EG, Gualix J, Costa MR, Schroeder T, Miras-Portugal MT, Ortega F. Live imaging followed by single cell tracking to monitor cell biology and the lineage progression of multiple neural populations. J Vis Exp. 2017 Dec 16;(130). doi: 10.3791/56291.
10. Gascón S, Ortega F, Götz M. Transient CREB-mediated transcription is key in direct neuronal reprogramming. Neurogenesis. 2017 Feb 6;4(1):e1285383. doi: 10.1080/23262133.2017.1285383.
11. Gascón S*, Murenu E*, Masserdotti G, Ortega F, Russo G, Petrik D, Deshpande A, Heinrich C, Karow M, Robertson S, Schroeder, Beckers J, Irmler M, Berndt C, Friedmann JP, Conrad M, Berninger B, Götz M. Identification and successful negotiation of a metabolic checkpoint in direct neuronal
reprogramming. Cell Stem Cell. 2016 Mar 3;18(3):396-409. doi: 10.1016/j.stem.2015.12.003 This work has been highlighted by F1000Prime as being of special significance in its field. https://f1000.com/prime/726066295?subscriptioncode=3248f6ce-490a-498d-963a-b4374a3300a9 [See also Previews, by Quadrato G, Zhang AC, Arlotta P (2016) Stressed out? Healing tips for newly reprogrammed neurons, Cell Stem Cell 18: 297-299].
12. Sirko, S, Irmler M, Gascón S, Bek S, Schneider S, Dimou L, Obermann J, De Souza Paiva D, Poirier F, Beckers J, Hauck SM, Barde YA, Götz M. Astrocyte reactivity after brain injury: The role of galectins 1 and 3. Glia. 2015 Dec;63(12):2340-61. doi: 10.1002/glia.22898
13. Faiz M, Sachewsky N, Gascón S, Bang KW, Morshead CM, Nagy A. Adult Neural Stem Cells from the Subventricular Zone Give Rise to Reactive Astrocytes in the Cortex after Stroke. Cell Stem Cell. 2015 Nov 5;17(5):624-34. doi: 10.1016/j.stem.2015.08.002
14. Heinrich C*, Bergami M*, Gascón S, Lepier A, Viganò F, Dimou L, Sutor B, Berninger B, Götz M. Sox2-mediated conversion of NG2 glia into induced neurons in the injured adult cerebral cortex. Stem Cell Reports. 2014 Dec 9;3(6):1000-14. doi: 10.1016/j.stemcr.2014.10.007
15. Ortega F, Gascón S*, Masserdotti G*, Deshpande A, Simon C, Dimou L, Lie C, Schroeder T, Berninger B. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nature Cell Biology. 2013 Jun;15(6):602-13. doi: 10.1038/ncb2736
16. Karow M*, Sánchez R*, Schichor, C, Masserdotti G, Ortega F, Heinrich C, Gascón S, Kahn A, Lie C, Dellavalle A, Cossu G, Goldb-runner R, Götz M, Berninger B. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 2012 Oct 5;11(4):471-6. doi: 10.1016/j.stem.2012.07.007
17. Vidaurre OG*, Gascón S*, Deogracias R, Sobrado M, Cuadrado E, Montaner J, Rodríguez-Peña A, Diaz-Guerra M. Imbalance of neurotrophin receptor isoforms TrkB-FL/TrkB-T1 induces neuronal death in excitotoxicity. Cell Death & Disease. 2012 Jan 19;3:e256. doi: 10.1038/cddis.2011.143
18. Heinrich C, Gascón S, Masserdotti G, Lepier A, Sanchez R, Simon-Ebert T, Schroeder T, Götz M, Berninger B.Generation of subtype-specific neurons from postnatal astroglia of the mouse cerebral cortex. Nature Protocols. 2011 Feb;6(2):214-28. doi: 10.1038/nprot.2010.188
19. Heinrich C, Blum R*, Gascón S*, Masserdotti G*, Tripathi P, Sánchez R, Tiedt S, Schroeder T, Götz M, Berninger B. Directing astroglia from the cerebral cortex into subtype specific functional neurons. PLoS Biology. 2010 May 18;8(5):e1000373. doi: 10.1371/journal.pbio.1000373
20. Brill MS*, Ninkovic J*, Winpenny E*, Hodge RD*, Ozen I, Yang R, Lepier A, Gascón S, Erdelyi F, Szabo G, Parras C, Guillemot F, Frotscher M, Berninger B, Hevner RF, Raineteau O, Götz M. Adult generation of glutamatergic olfactory bulb interneurons. Nature Neuroscience. 2009 Dec;12(12):1524-33. doi: 10.1038/nn.2416
21. López-Menéndez C, Gascón S, Sobrado M, Vidaurre OG, Higuero AM, Rodríguez-Peña A, Iglesias T, Díaz-Guerra M. Kidins220/ARMS downregulation by excitotoxic activation of NMDARs reveals its involvement in neuronal survival and death pathways. Journal of Cell Science. 2009 Oct 1;122(Pt 19):3554-65. doi: 10.1242/jcs.056473
22. Gascón S, Paez-Gomez JA, Díaz-Guerra M, Scheiffele P, Scholl FG. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. Journal of Neuroscience Methods. 2008 Feb 15;168(1):104-12. doi: 10.1016/j.jneumeth.2007.09.023
23. Gascón S, Sobrado M, Roda JM, Rodríguez-Peña A, Díaz-Guerra M. Excitotoxicity and focal cerebral ischemia induce truncation of the NR2A and NR2B subunits of the NMDA receptor and cleavage of the scaffolding protein PSD-95. Molecular Psychiatry. 2008 Jan;13(1):99-114. We provided the cover in this issue. doi: 10.1038/sj.mp.4002017
24. Gascón S*, García-Gallo M*, Renart J, Díaz-Guerra M. Endoplasmic reticulum-associated degradation of the NR1 but not the NR2 subunits of the
N-methyl-D-aspartate receptor induced by inhibition of the N-glycosylation in cortical neurons. Journal of Neuroscience Research. 2007 Jun;85(8):1713-23. doi: 10.1002/jnr.21309
25. Gascón S, Deogracias R, Sobrado M, Roda JM, Renart J, Rodríguez-Peña A, Díaz- Guerra M. Transcription of the NR1 subunit of the N-methyl-D-aspartate receptor is down-regulated by excitotoxic stimulation and cerebral ischemia. The Journal of Biological Chemistry. 2005 Oct 14;280(41):35018-27. doi: 10.1074/jbc.M504108200
Contacto
Dónde encontrarnos
Laboratorio de Reprogramación neuronal directa aplicada al estudio y tratamiento de enfermedades del sistema nervioso central
Instituto Cajal CSIC. Avda. Doctor Arce, 37. 28002. Madrid
Llámanos
Teléfono:
Escríbenos un mensaje
Correo electrónico:
Otros
Colaboraciones
-
Ana Martínez Gil. Centro de Investigaciones Biológicas
-
Margarita Salas. España.
-
Alicia González Martín. Instituto de Investigaciones Biomédicas “Alberto Sols”. España.
-
Benedikt Berninger. Centre for Developmental Neurobiology, King´s College of London. Reino Unido.
-
Christophe Heinrich. Stem Cell and Brain Research Institute – INSERM, Lyon. Francia.
-
Dora Brites. Faculty of Pharmacy, University of Lisbon, Lisbon, Portugal.
-
Eva de Lago Femia. Facultad de Medicina. Universidad Complutense de Madrid. España.
-
Felipe Ortega. Facultad de Veterinaria, Universidad Complutense de Madrid. España
-
Fernando de Castro Soubriet. Departamento de Neurobiología Celular, Molecular y del Desarrollo. Instituto Cajal (CSIC). España.
- Francisco Manuel Gómez Scholl. Departamento de Fisiología Médica y Biofísica, IBiS. Facultad de Medicina. Universidad de Sevilla. España.
- José Luis Trejo Pérez. Departamento. Departamento de Neurociencia Traslacional. Instituto Cajal (CSIC). España.
-
Laura López Mascaraque. Departamento de Neurobiología Celular, Molecular y del Desarrollo. Instituto Cajal (CSIC). España.
-
Magdalena Götz. Ludwig-Maximilians-University of Munich. Alemania.
-
María del Valle Palomo Ruiz. Instituto Madrileño de Estudios Avanzados. España.
-
Toni del Río. Instituto Biotecnología de Cataluña (IBEC). Barcelona. España.
Financiación
- Proyectos científicos.
1) Proyecto “Papel del regulador epigenético Ring1B en la determinación del subtipo neuronal durante neurogénesis adulta y reprogramación neuronal”, Proyectos de Generación del Conocimiento 2021. Ministerio de Ciencia e Innovación. (PID2021- 128796OB-I00). 01/01/2022 – 31/12/2024.
2) Proyecto «Targeting TDP-43 with protein kinase inhibitors: an effective and measurable therapy for ALS?» Fundación La Caixa (LCF/PR/HA21/52350003; Consorcio CSIC, FARM- ID, UCM e IMDEA). 1/11/2021 –1/11/2024.
3) Proyecto “Análisis de la Conectividad Sináptica entre Neuronas Inducidas” (Ref. 202020E061). Instituto Cajal. Desde 15/01/2020.
4) Proyecto “Papel de las celulas mieloides infiltradas y la macroglia reactiva en la reprogramación neuronal directa de celulas de raton y humanas”. Programa nacional de investigación orientada a los retos de la sociedad. Ministerio de Ciencia, Innovación y Universidades (RTI2018-099345-B-I00). 01/01/2019 – 01/09/2022.
5) Proyecto “Modelling ALS disease in vitro”-MAIV 01EK1611A. Federal Ministry of Education and Research (BMBF-Alemania). 01/02/2017 a 01/02/2022.
6) Proyecto – ayuda Ramon & Cajal. Ministerio de Ciencia, Innovación y Universidades (RYC-2015-19185). 31/08/2017 – 30/08/2022. - Financiación obtenida por estudiantes/investigadores asociados al equipo de investigación.
1) Beca postdoctoral CONACyT (Consejo Nacional de Ciencia y Tecnología, México) de la Dra. Dulce María Arzate. 30/09/2020 a 30/09/2022.
2) Beca JAE Intro – CSIC de Ana Victoria Prádanos Senén. 2021-2022.
3) Contrato “Grarantía Juvenil” (Comunidad de Madrid) de Víctor Álvaro Sánchez. 01/05/2021 – 01/05/2023.

Centro de investigación en neurociencias dependiente del CSIC. Fundado en 1920 y dirigido en sus inicios por Santiago Ramón y Cajal. Referente mundial en el estudio del cerebro. Depositario del Legado Cajal.
Actividades








