LABORATORIOS
Fisiología molecular del comportamiento
Fisiología molecular del comportamiento
Investigación
Personal
Publicaciones
Contacto
Otros
Investigación

Líneas de investigación
Línea 1.- Funciones del eje neuro-hormonal PTTH/Torso de Drosophila en la fisiología adulta
El eje neuroendocrino responsable de la transición juvenil adulto es probable que ya estuviera presente en el antecesor de vertebrados e insectos. En Drosophila el gen ptth (y su receptor torso) tiene funciones equivalentes a GnRH (y su receptor GnRHR) de vertebrados durante esta transición. Sin embargo, en ambos casos ptth y GnRH se expresan en el cerebro adulto con funciones no bien descritas. Nuestro objetivo es estudiar en Drosophila dichas funciones, determinando las redes celulares utilizadas por PTTH/Torso para regular procesos fisiológicos sistémicos y el perfil transcripcional en los tejidos diana de animales mutantes para ptth.
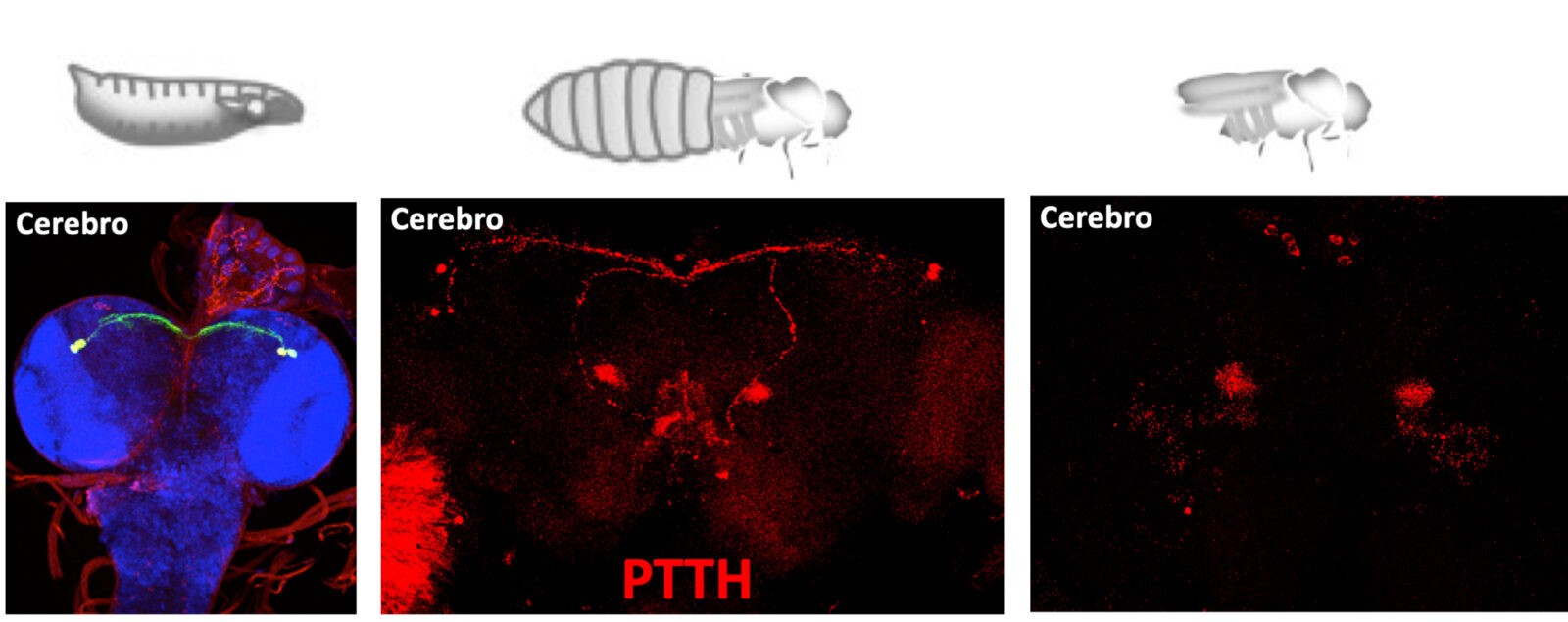
Fig 1.- Expresión de ptth en el cerebro de la larva, en moscas jóvenes recién surgidas de la pupa y en animales envejecidos.
Linea 2.- Bases genómicas de la memoria a largo plazo
La formación de memoria a largo plazo requiere cambios en la actividad transcripcional. Dada la conservación de los mecanismos moleculares de la memoria conocidos hasta ahora entre las diferentes especies utilizaremos la mosca del vinagre junto a las herramientas genéticas y -omicas disponibles para contestar dos preguntas sobre la memoria. Por un lado, estudiar si la interacción social causa una memoria específica causante de cambios en el comportamiento. Por otro, determinar los cambios transcripcionales durante la reactivación de la memoria, probando funcionalmente los genes candidatos más relevantes. Los resultados obtenidos permitirán conocer si hay un patrón conservado entre tipos de memoria o incluso entre especies.
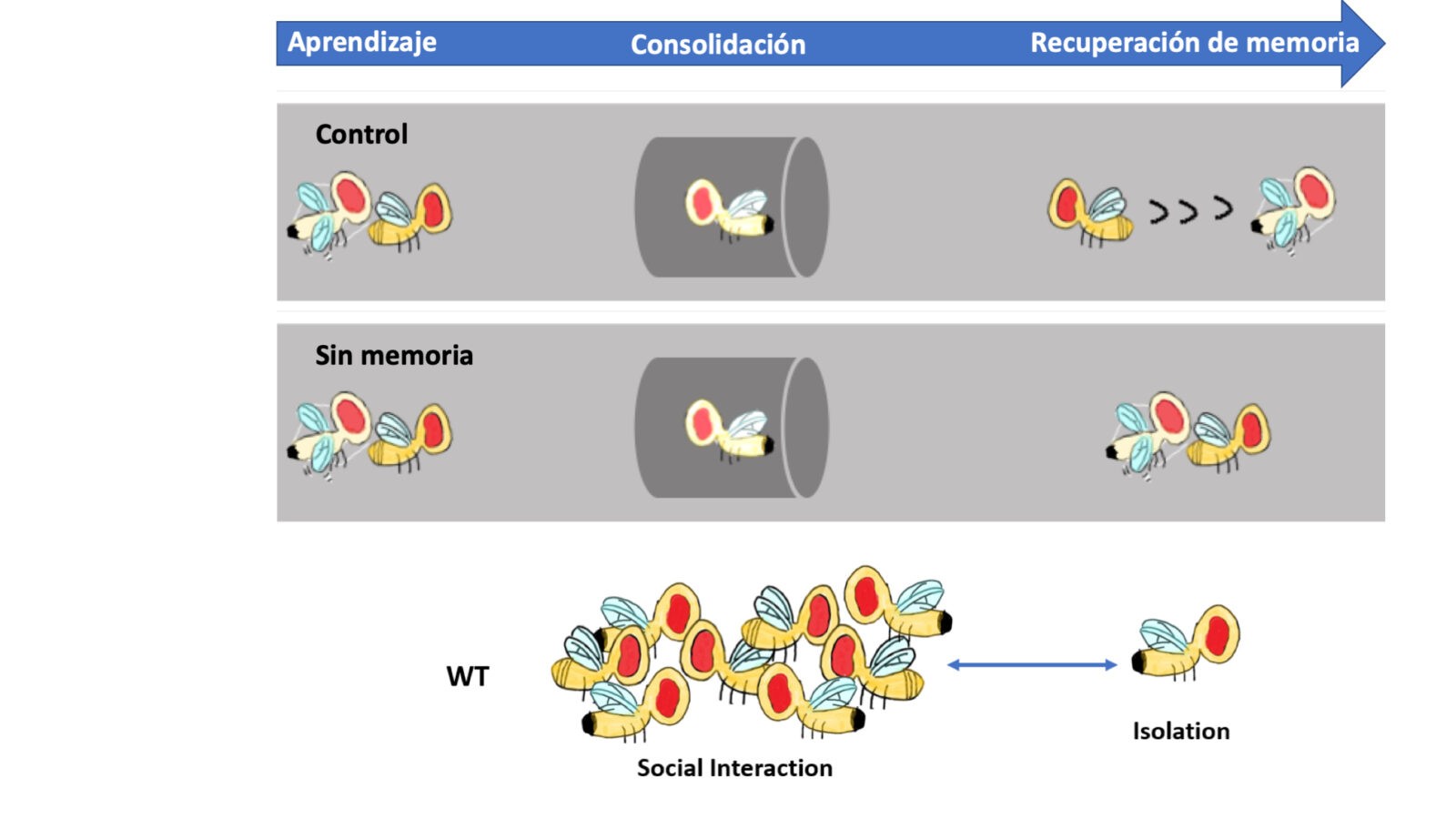
Figura 2.- Los paradigmas de aprendizaje usados en el laboratorio. Un macho, tras cortejar a una hembra sin éxito, al volver a enfrentarse al estímulo (hembra) disminuye su tiempo de cortejo. En un mutante de memoria la mosca corteja como la primera vez. En el ensayo de interacción social, comparamos moscas que han crecido sociales (social interaction) con moscas crecidas en soledad (isolation).
Linea 3.- Efecto de un envejecimiento saludable en las capacidades cognitivas
Dado el incremento en enfermedades neurodegenerativas y problemas cognitivos que acompañan a una población cada vez más envejecida, uno de los objetivos de nuestra sociedad es mantener una mejor calidad de vida en la vejez. Se ha demostrado que el ejercicio moderado mejora varios aspectos fisiológicos alterados por la edad. Esta línea de investigación pretende establecer Drosophila como modelo para estudiar a nivel molecular el efecto del ejercicio en la función del cerebro durante el envejecimiento. También estamos interesados en estudiar las consecuencias funcionales de alterar los niveles de PTTH durante el declive causado por la edad, prestando atención a diferencias de género. Esperamos que nuestros resultados permitan explorar nuevos caminos para contrarrestar el efecto del envejecimiento en humanos.
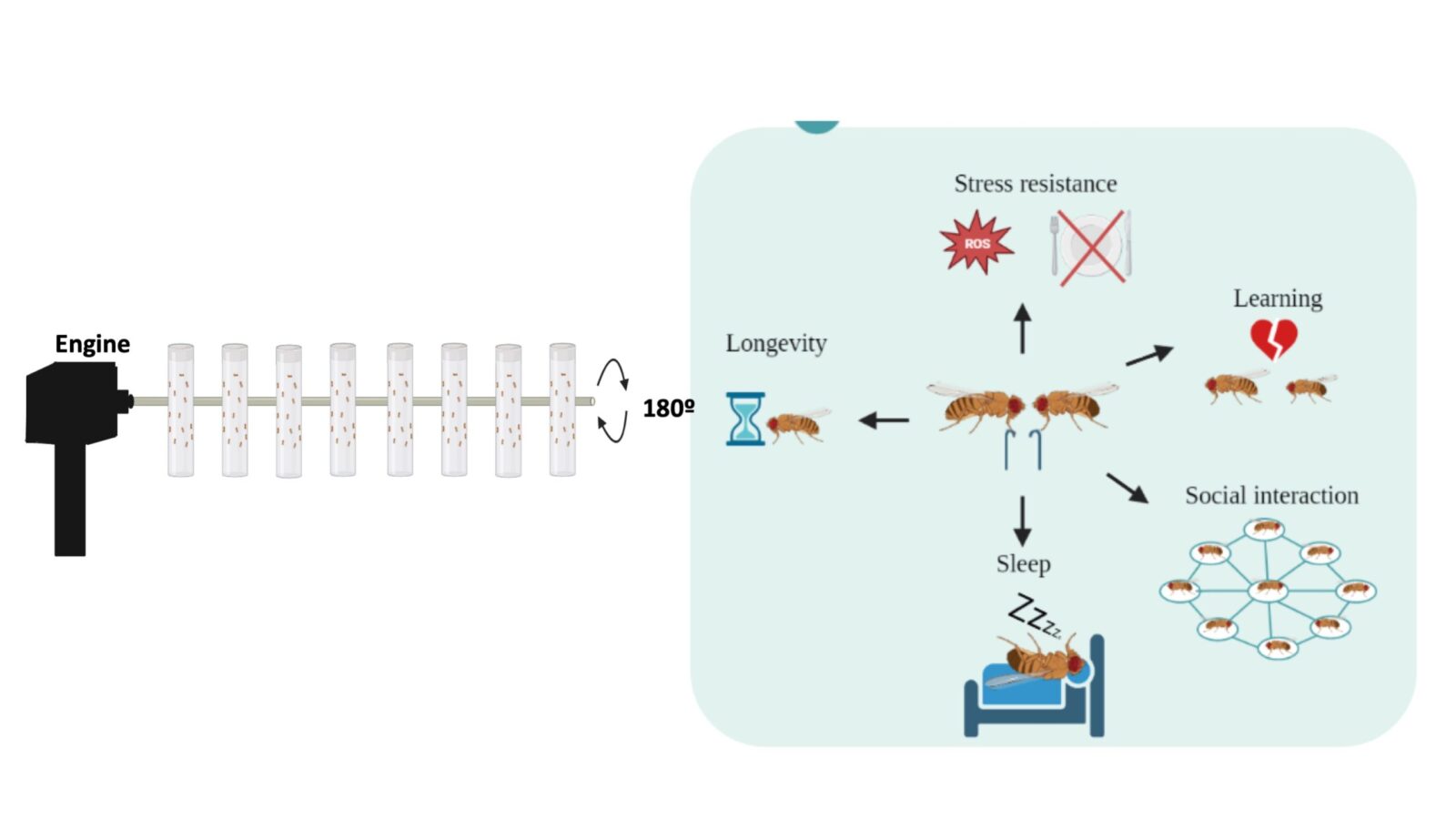
Figura 3.- El aparato empleado para ejercitar moscas durante 5 días. Posteriormente se deja envejecer a los animales 25 días y se testa como mejora diferentes aspectos cognitivos y fisiológicos: aprendizaje, interacción social, sueño, resistencia a estrés y longevidad.
Personal

Francisco A. Martín Castro
Investigador principal

Maria del Carmen Rodriguez Navas
Técnico de laboratorio

Esther Seco Martín
Técnico de laboratorio

Celia González Barredo
Investigadora predoctoral, UAM (FPI- UAM)

Beatriz Gil Martí
Investigadora predoctoral, UAM (FPI- UAM)

Sara Piña Flores
Investigadora predoctoral, UAM (FPU)

Julia Isidro Mezcua
Estudiante de TFM, UAM (JAE intro-CSIC)

Irene Camacho Agudo
Estudiante de TFG, UCM
Publicaciones
Publicaciones
- A simplified Courtship Conditioning protocol to test learning and memory in Drosophila. Gil-Marti B*, Barredo CG, Pina-Flores S, Poza-Rodriguez A, Treves G, Rodriguez-Navas C, Camacho L, Pérez-Serna A, Jimenez I, Brazales L, Fernandez J, Martín FA* (2023). STAR protocols 4:101572; DOI: 10.1016/j.xpro.2022.101572
- Alignment between glioblastoma internal clock and environmental cues ameliorates survival in Drosophila. Jarabo P, Barredo CG, De Pablo C, Casas-Tinto S*, Martín FA* (2022). Communications Biology 5, 644; DOI: 10.1038/s42003-022-03600-9
- The elusive transcriptional memory trace. Gil-Marti B, Barredo CG, Pina-Flores S, Trejo JL, Turiegano E, Martín FA* (2022). Oxford Open Neuroscience. Volume 1, kvac008; DOI: 10.1093/oons/kvac008.
- Editorial: Behavior-Driven Changes in Gene Expression. Ferrus A*, Martín FA*, Tuesta LM*, Martín-Peña A* (2022) Frontiers in Behavioral Neuroscience 16:839395.
- Barredo CG, Gil-Marti B, Deveci D, Romero NM*, Martín FA* (2021). Timing the juvenile-adult neurohormonal transition: functions and evolution. Frontiers in Endocrinology 11:602285
- Insulin signaling mediates neurodegeneration in glioma. Jarabo P, De Pablo C, Herranz H, Martín FA*, Casas-Tinto S* (2021). Life Science Alliance 4 (3) e202000693; DOI: 10.26508/lsa.
- Glioblastoma models in Drosophila melanogaster. Losada-Pérez M*, Jarabo P*, Martín FA*, Casas-Tintó S* (2020). In: eLS. John Wiley & Sons, Ltd:Chichester. DOI: 10.1002/9780470015902.a0022540.pub2
- AstA signaling functions as an evolutionary conserved mechanism timing juvenile to adult transition. Deveci D, Martín FA, Leopold P, Romero NM (2019). Current Biology 29, 813-822. DOI 10.1016/j.cub.2019.01.053
- Prothoracicotropic hormone modulates environmental adaptive plasticity through the control of developmental timing. Shimell MJ, Pan X, Martín FA, Ghosh AC, Leopold L, O’Connor MB, Romero NM (2018). Development 145: dev159699. DOI: 10.1242/dev.159699
- Neurogenetics of Drosophila circadian clock: expect the unexpected. Jarabo P, Martín FA* (2017). Journal of Neurogenetics 4:1-16. DOI: 10.1080/01677063.2017.1370466
- Ligand independent requirements of steroid receptors EcR and USP for cell survival. Mansilla A*, Martín FA*, Martín D, Ferrús A (2016). Cell Death and Differentiation 23:405-16. DOI: 10.1038/cdd.2015.108.
Contacto
Dónde encontrarnos
Grupo de Fisiología Molecular del Comportamiento. Laboratorio C-22
Instituto Cajal CSIC. Avda. Doctor Arce, 37. 28002. Madrid
Llámanos
Teléfono:
Escríbenos un mensaje
Correo electrónico:
Otros
Proyectos concedidos
- Memory mark for learning coding. Proyecto PID: 10560 (EASI-Genomics; Infraestructura Europea de Genómica – H2020). Duración: 2020-2021.
- Funciones del eje neuro-hormonal ptth/torso de Drosophila en la fisiología adulta. Proyecto PGC2018-094630-B-I00 (MICINN, proyectos de I+D de Generación de Conocimiento). Duración: 2019-2022.
- Chromatin changes associated to memory. Proyecto de internacionalización I-LINK1179 (CSIC-Programa I+LINK2017). Duración: 2018-2019. Investigador Principal (coordinador). Grupos participantes: A. Brand (Gurdon Institute, Cambridge, Reino Unido), G. Gilestro (Imperial College, Londres, Reino Unido) y J. L. Pons (Instituto Cajal, Madrid, España)
- Interacciones funcionales entre los sistemas circadiano, locomotor y neuroendocrino. Proyecto BFU2014-54346-JIN (MINECO, Proyectos de I+D+I para Jóvenes Investigadores-Programa Retos). Duración: 2015-2018.
Tesis Doctorales
- «Análisis de alteraciones circadianas en un modelo de glioblastoma». Patricia Jarabo Blazquez. Fecha de lectura: 24 de mayo de 2021. Universidad Autónoma de Madrid. Sobresaliente Cum Laude. Directores: Sergio Casas Tintó y Francisco A Martín.
- Celia Gonzalez Barredo. Tesis en curso. Universidad Autónoma de Madrid. Directores: Alberto Ferrús y Francisco A Martín. Becaria FPU (MICINN).
- Beatriz Gil-Martí. Tesis en curso. Universidad Autónoma de Madrid. Directores: Enrique Turiégano y Francisco A Martín. Becaria FPI (UAM).
- Sara Piña Flores. Tesis en curso. Universidad Autónoma de Madrid. Directores: Jose Luis Trejo y Francisco A. Martín. Becaria FPU (MICINN).
TFM
- Julia Isidro Mezcua. Trabajo Fin de Máster de Neurociencia (Universidad Autónoma de Madrid) 2022-23. Director: Francisco A Martín. En curso (2023). Beca JAE intro (CSIC, 2022).
- «The role of memory in regulating isolation-dependent Drosophila aggression». Gaia Treves. Trabajo Fin de Máster de Cellular and Molecular Biology (University of Turin, Italia) 2022. Director: Francisco A Martín. Beca Erasmus+.
- «El papel de las hormonas en la regulación de la ingesta y metabolismo usando Drosophila como modelo». Sara Piña Flores. Trabajo Fin de Máster de Neurociencia (Universidad Autónoma de Madrid) 2022. Director: Francisco A Martín. Beca JAE intro (CSIC, 2021).
- «Role of the Drosophila PTTH/Torso neuroendocrine axis in resistance to metabolic stress»Aberto Damborenea Moreno. Trabajo Fin de Máster de Neurociencia (Universidad Complutense de Madrid) 2020. Director: Francisco A Martín.
- «Nuevas funciones del eje neuro-hormonal PTTH/TORSO en la etapa adulta de Drosophila melanogaster«. Beatriz Gil Martí. Trabajo Fin de Máster de Neurociencia (Universidad Autónoma de Madrid). 2019. Director: Francisco A Martín. Beca JAE intro (CSIC, 2019). Beca de Fomento de la Investigación (UAM, 2018). Beca Erasmus+ de Prácticas en el laboratorio del Dr Gilestro (Imperial College, Londres; junio-julio 2018).
- «Estudio del papel del neuropéptido PTTH en el comportamiento y fisiología de Drosophila melanogaster«. Celia González BarredoTrabajo Fin de Máster de Neurociencia (Universidad Autónoma de Madrid). 2018. Director: Francisco A Martín. Beca de Fomento de la Investigación (UAM, 2018).
- «Neurodegeneración causada por el desarrollo de un glioma y estudio de su efecto disruptivo sobre los ritmos circadianos». Patricia Jarabo Blázquez. Trabajo Fin de Máster Genética y Biología Celular (Universidad Complutense de Madrid). 2016. Directores: Francisco A Martín y Sergio Casas Tintó.
TFG
- Irene Camacho Casero. Trabajo de Fin de Grado, Grado en Biología (Universidad Complutense de Madrid), 2022. En curso (2023).
- «Assembly, configuration and use of an Ethoscope platform». Claudia Zaldívar Hurtado de Mendoza. Trabajo de Fin de Grado, Grado de Ingeniería Biomédica (Universidad Rey Juan Carlos), 2022. Director: Francisco A Martín.
- «Efectos del aislamiento en el comportamiento de Drosophila melanogaster. ¿Un problema de memoria?». Adriana Poza Rodríguez. Trabajo Fin de Grado, Grado Biología (Universidad Autónoma de Madrid), 2022. Director: Francisco A Martín.
- «Analysis of chromatin changes associated to memory formation and neural activity». Rafael Javier Pérez Pelizón. Trabajo Fin de Grado, Grado Ingeniería Biomédica (Universidad San Pablo-CEU). 2019. Directores: Francisco A Martín, Diego Torricelli.
- «Study of long-term memory-associated genes and chromatin states in Drosophila melanogaster«. Pablo Ligero Isla. Trabajo Fin de Grado, Grado Ingeniería Biomédica (Universidad San Pablo-CEU). 2019. Director: Francisco A Martín.
- «Papel de la hormona ptth en los ritmos circadianos utilizando Drosophila melanogaster como modelo». Laura Pérez-Galdós Robledo. Trabajo Fin de Grado, Grado Biología (Universidad Autónoma de Madrid). 2017. Director: Francisco A Martín.
- «Influencia de la hormona ptth en la memoria visual de Drosophila melanogaster«. Alba Beatriz Fernández Navarro. Trabajo Fin de Grado, Grado Biología (Universidad Complutense de Madrid). 2017. Director: Francisco A Martín.
Docencia
- Profesor invitado en el curso «memoria y aprendizaje» del Máster en Neurociencias fundamental y traslacional de la Universidad Pablo de Olavide de Sevilla (desde 2023)
- Profesor invitado en el curso «Neurobiología Celular: fisiología de las membranas excitables» del Máster de Neurociencia de la Universidad Autónoma de Madrid (2016-2023)
- Profesor Invitado en el XIV Curso Nacional de Neurociencia (2017)
Divulgación
- Entrevistas
http://play.cadenaser.com/audio/cadenaser_laventana_20171002_190000_200000/
http://www.elmundo.es/ciencia-y-salud/salud/2017/10/02/59d1f31de2704e6f638b4647.html
https://www.radiocaldes.cat/programs/santuaridimecresales10hquinzenal/radiocaldes_podcast_12864
- Conferencia «la carrera científica», incluida en el Catálogo de Conferencias del CSIC dirigido a la Comunidad Educativa de la Comunidad de Madrid
Colaboraciones
- Dr Tony Southall, Dr Marc Dionne y Dr Giorgio Gilestro (Imperial College, Londres, Reino Unido)
- Dr Jamie Kramer (Dalhousie University, Halifax, Cánada)
- Dra Nuria M Romero (Institute Sophia Agrobiotech, Biot, Francia)
- Dr Esteban Beckwith (IFIBYNE, Buenos Aires, Argentina)
- Dr Enrique Turiégano (Departamento de Biología, Universidad Autónoma de Madrid, España)
- Dr Sergio Casas Tintó (Instituto de Investigación de Enfermedades Raras-ISCIII, Madrid, España)
- Dr Jose Luis Trejo (Instituto Cajal-CSIC, Madrid, España)

Centro de investigación en neurociencias dependiente del CSIC. Fundado en 1920 y dirigido en sus inicios por Santiago Ramón y Cajal. Referente mundial en el estudio del cerebro. Depositario del Legado Cajal.
Actividades
