LABORATORIOS
Control molecular de la neurogénesis
Control molecular de la neurogénesis
Investigación
Personal
Publicaciones
Contacto
Otros
Investigación
Nuestro laboratorio está interesado en entender cuáles son las bases moleculares que gobiernan la generación de nuevas neuronas, tanto durante el desarrollo del sistema nervioso como en el cerebro adulto. La generación de nuevas neuronas o neurogénesis se mantiene, de forma limitada, en nichos discretos del sistema nervioso adulto de muchos vertebrados durante toda la vida del animal y contribuye a la plasticidad del sistema nervioso. Sin embargo, esta neurogénesis adulta es muy restringida, tanto en número total como en subtipos neurales distintos generados. Nuestro laboratorio está interesado en explorar cómo se pueden modular las tasas de generación celular y la extensión temporal de la neurogénesis en el cerebro adulto en comparación con el proceso de neurogénesis durante el desarrollo.

A lo largo de los años, hemos contribuido a comprender cuáles son las señales y los programas genéticos que rigen el desarrollo neuronal. En cuanto a las señales, hemos demostrado que la señalización de FGF y de ácido retinoico son esenciales para el control temporal de la especificación y la migración de las células de la cresta neural (Martínez-Morales, et al., 2011, Diez del Corral y Morales, 2014). Además, hemos demostrado que la vía de FGF modula la actividad de la vía de señalización Shh para controlar la identidad ventral de la médula espinal (Morales et al., 2016).
También hemos contribuido a establecer cómo se controla la neurogénesis y la especificación de destino celular durante el desarrollo a través de la modulación de vías de señalización, como la de la vía canónica de Wnt. En ese sentido, el laboratorio también ha establecido como factores intrínsecos, como el factor de transcripción Sox5, promueven la salida del ciclo celular en progenitores neurales y la especificación de subtipos interneuronales en la médula espinal en desarrollo, modulando la vía canónica de Wnt (Martinez-Morales et al., 2010; Quiroga et al., 2015).
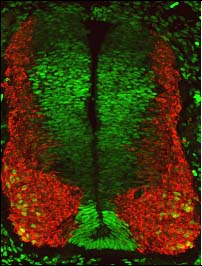
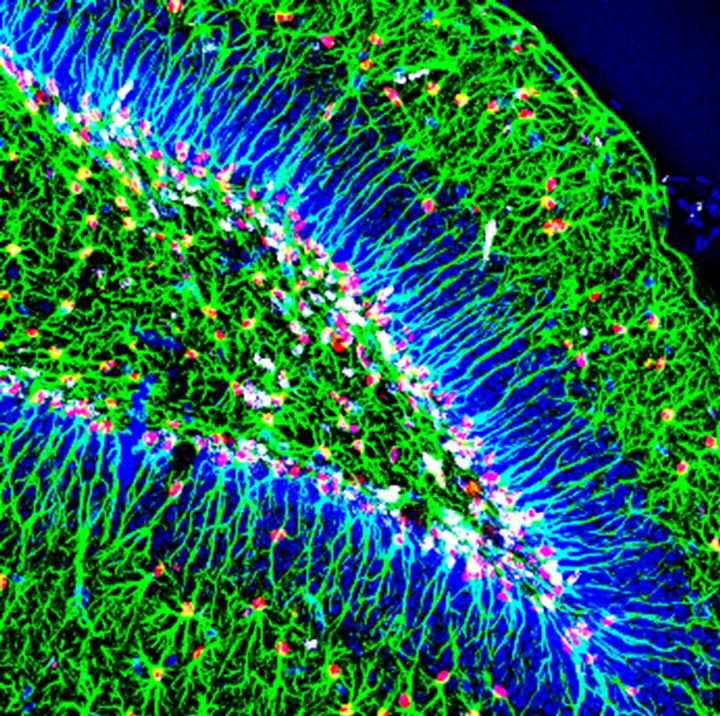
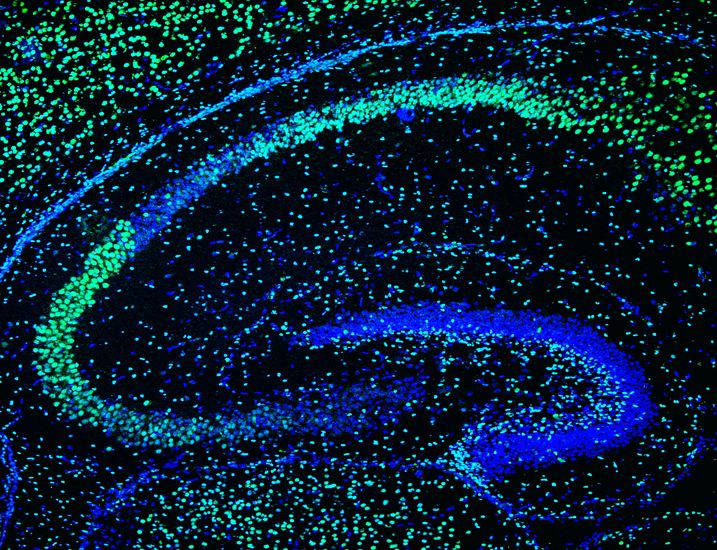
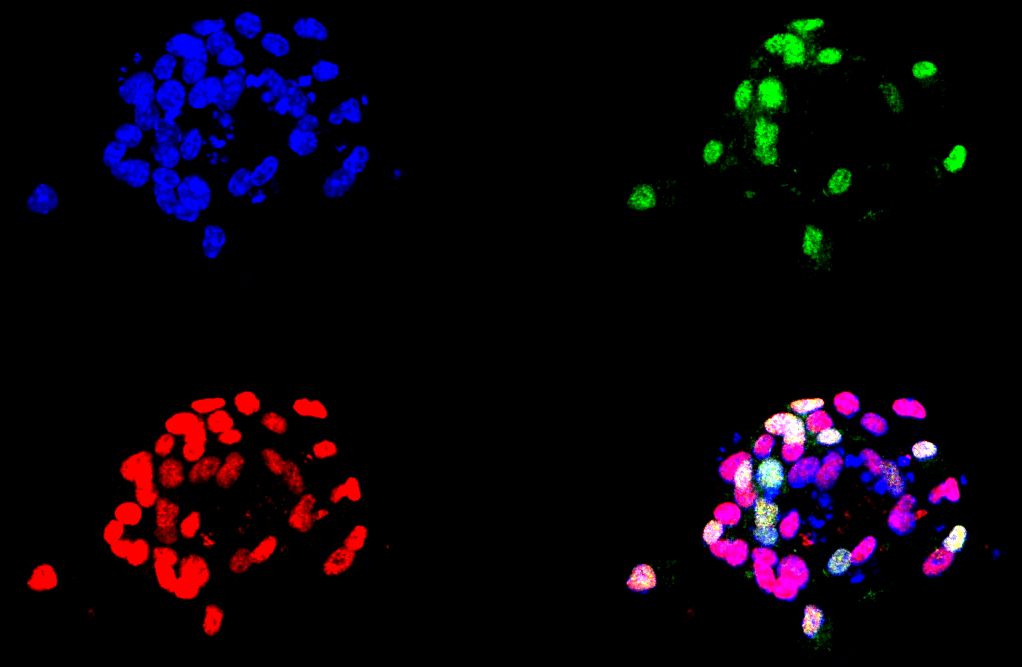
En la actualidad, estamos estudiando cómo se generan nuevas neuronas a partir de células madre en el cerebro adulto y cuándo y cómo, durante el desarrollo del cerebro, las células madre neurales adultas se generaron en ciertas áreas específicas del cerebro, como el giro dentado (GD) del hipocampo (Mira y Morales, 2019). En el GD del adulto, las células madre neurales (CMNs) generan nuevas células granulares a lo largo de la vida. La mayoría de esas CMNs se encuentran en un estado reversible de quiescencia, que protege el DNA de las células de posibles daños y evita el agotamiento del pool neural. Sin embargo, se sabe poco de cómo se regula la adquisición de la quiescencia y cómo se controla la transición de la quiescencia a un estado mitótico activo. Para comprender este proceso clave, nuestro laboratorio está explorando las consecuencias de la falta condicional de función de Sox5 y Sox6 en el hipocampo adulto de ratón y durante el desarrollo del giro dentado, utilizando enfoques tanto in vivo como in vitro (cultivo de neurosferas).
Además, también estamos interesados en el potencial de las células madre neurales adultas como herramientas terapéuticas en enfermedades neurodegenerativas. Recientemente hemos descubierto cómo inhibidores de una proteína involucrada en enfermedades neurodegenerativas (LRRK2) pueden promover la generación de oligodendrocitos y neuronas a partir de células madre neuronales del cerebro adulto (Zaldívar et al., 2020).
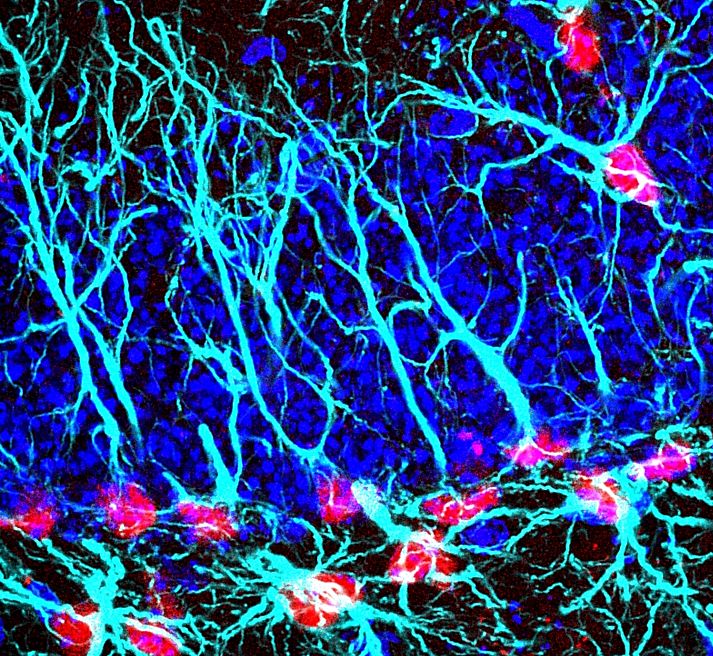
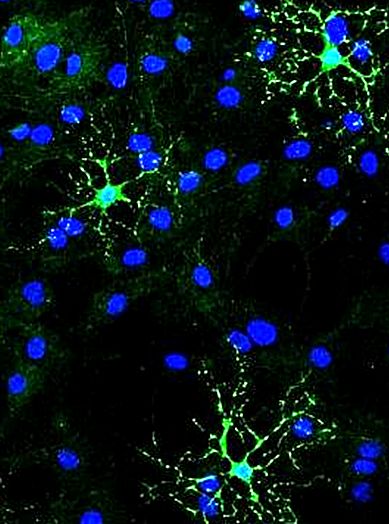
Personal

Aixa V. Morales
Investigadora principal
Publicaciones
Publicaciones recientes
- SoxD genes are required for adult neural stem cell activation. (2022) Li, L.*, Medina-Menéndez, C.*, García-Corzo, L., Quiroga, A.C., Calleja, E., Córdoba, C., Zinchuk, V., Muñoz, S., Rodríguez-Martín, P., Ciorraga, M., Colmena, I., Fernández, S., Vicario-Abejón, C., Nicolis S., Lefebvre, V., Mira, H. and Morales, AV. Cell Reports 38:110313. [Portada]. (* igual contribución).
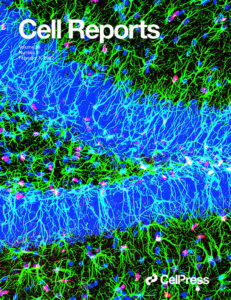
- Sublayer- and cell-type-specific neurodegenerative transcriptional trajectories in hippocampal sclerosis. (2021). E. Cid, A. Márquez-Galera, M. Valero, B. Gal, D. C. Medeiros, C. M. Navarrón, L. Ballesteros-Esteban, R. Reig-Viader, Morales, A.V. L. Dolon, I. Fernandez-Lamo, D. Gomez-Dominguez, M. Sato, Y. Hayashi, À. Bayés, A. Barco, J. P López-Atalaya, L. M de la Prida. Cell Reports 35(10):109229
- Editorial: Generation of Neurons and Their Integration in Pre-existing Circuits in the Postnatal Brain: Signalling in Physiological and Regenerative Contexts. (2020). Mira H, Diez Del Corral R, Morales, A.V. Front Cell Dev Biol. 8:560 (2020) Electronic Book Collection 2020.
- Benzothiazole-based LRRK2 inhibitors as WNT enhancers and promoters of oligodendrocytic fate. (2020). Zaldivar-Diez, J., Li, L., García, A.M., Zhao , W., Medina-Menendez, C., Haggarty, S.J., Gil, C., Morales, A.V.* and Martinez, A*. (*corresponding authors). Journal of Medicinal Chemistry 63(5):2638-2655.
- Adult neural stem cells: born to last. (2019). A. V. Morales, and H. Mira. Front. Cell Dev. Biol. Jun 4;7: 96
- Proximodistal organization of the CA2 hippocampal area. (2019). I. Fernandez-Lamo, D. Gomez-Dominguez, A. Sanchez-Aguilera, A. Oliva, A. V. Morales, M. Valero, E. Cid, A. Berenyi and L. Menendez de la Prida.Cell Reports 26 (7): 1734-1746 [Portada]
- A focused library of psychotropic analogs with neuroprotective and neuroregenerative potential. (2019). Uliassi, E.; Peña-Altamira, L. E.; Morales, A.V.; Massenzio, F.; Petralla, S; Rossi, M; Roberti, M.; Martinez Gonzalez, L.; Martínez, A.; Monti, B.; Bolognesi, M. L. ACS Chemical Neuroscience Jan 16;10(1):279-294.
- GLI1 Inactivation is associated with Developmental Phenotypes Overlapping with Ellis-Van Creveld Syndrome (2017).A. Palencia-Campos, A. Ullah, J.Nevado, R. Yıldırım, E.Unal, M. Ciorraga, P., Lucia Chico, F. Piceci-Sparascio, V. Guida, A. De Luca, H. Kayserili, I. Ullah, M. Burmeister, P. Lapunzina, W. Ahmad, Morales, A.V., V. L. Ruiz-Perez. Human Molecular Genetics. 26(23):4556-4571. [Portada]

- Leucine Rich Repeat Kinase 2 (LRRK2) Inhibitors based on indolinone scaffold: Potential Pro-neurogenic Agents. (2017). Salado, I.G., Zaldivar-Diez, J., Sebastian, V., Li, L., Geiger, L., González, S., Campillo, N.E., Morales, A.V.,, Perez, D.I. and Martinez, A. European Journal of Medicinal Chemistry 138:328-342.
- The multiple roles of FGF signaling in the extending spinal cord. (2017). Diez del Corral, R. and Morales, A.V. Front. Cell Dev. Biol. Jun 2;5:58.
- Brain insulin-like growth factor-I directs the transition from stem cells to mature neurons during postnatal/adult hippocampal neurogenesis. (2016). Nieto-Estevez, V, Oueslati-Morales, C.O., Li, L., Pickel, J., Morales, A.V., and Vicario-Abejon. Stem Cells 34(8):2194-209.
- FGF signaling enhances a Shh negative feedback loop to coordinate ventral patterning and caudal extension of the spinal cord.(2016). Morales, A.V., Espeso-Gil, S., Ocaña, I., Nieto-López, F., Calleja, E., Bovolenta, P., Lewandoski, M. and Diez del Corral, R. Developmental Neurobiology 76(9):956-71.
- Neural development and regeneration: it’s all in your spinal cord. (2015). Becker CG, Diez Del Corral R. Development 142: 811-816.
- Sox5 controls dorsal progenitor and interneuron specification in the spinal cord. (2014).Quiroga AC, Stolt CC, Diez del Corral R, Dimitrov S, Perez-Alcala S, Sock E, Barbas JA, Wegner M, Morales AV. Developmental Neurobiology. 75(5):522-38 (2015)
- Retinoic Acid Signaling during Early Spinal Cord Development. (2014).Morales AV, Diez del Corral R. Journal Developmental Biology 2: 174-197.
- FGF and retinoic acid activity gradients control the timing of neural crest cell emigration in the trunk. (2011). Martinez-Morales, P.L., Diez Del Corral, R., Olivera-Martinez, I., Quiroga, A.C., Das, R.M., Barbas, J.A., Storey, K.G., and Morales, A.V. Jounal Cell Biology. 194:489-503.
- Coordination of Cell Differentiation and Migration in Mathematical Models of Caudal Embryonic Axis Extension. (2011). Harrison, N.C., Diez del Corral, R.*, and Vasiev, B.*PLoS ONE 6, e22700.*Co-corresponding authors.
- SOX5 controls cell cycle progression in neural progenitors by interfering with the WNT-beta-catenin pathway.(2010). Martinez-Morales, P.L., Quiroga, A.C., Barbas, J.A., and Morales, A.V. EMBO Reports 11, 466-472.
- Snail genes at the crossroads of symmetric and asymmetric processes in the developing mesoderm (2007). Morales AV, Acloque H, Ocaña OH, de Frutos CA, Gold V and Nieto MA. EMBO Reports. 8:104-109 [Portada].

- How to become neural crest: from segregation to delamination (2005) Morales AV, Barbas JA, Nieto MA. Semin Cell Dev Biol. 16(6):655-62.
- LSox5 regulates RhoB expression in the neural tube and promotes generation of the neural crest (2004). Perez-Alcala S, Nieto MA, Barbas JA. Development 131(18):4455-65.
Publicaciones relacionadas de miembros del laboratorio
- Snail blocks the cell cycle and confers resistance to cell death.(2004). Vega, S., Morales, A.V., Ocana, O.H., Valdes, F., Fabregat, I., and Nieto, M.A.Genes Dev 18, 1131-1143.
- The snail gene family in gastrulation.(2004). Morales, A.V. and Nieto M.A.In: Gastrulation. Ed: Stern, C. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Opposing FGF and retinoid pathways: a signalling switch that controls differentiation and patterning onset in the extending vertebrate body axis.(2004). Diez del Corral, R., and Storey, K.G.Bioessays 26, 857-869.
- Opposing FGF and retinoid pathways control ventral neural pattern, neuronal differentiation, and segmentation during body axis extension(2003).Diez del Corral, R., Olivera-Martinez, I., Goriely, A., Gale, E., Maden, M. and Storey, K.Neuron 40, 65-79.
- Periodic Lunatic fringe expression is controlled during segmentation by a cyclic transcriptional enhancer responsive to notch signalling (2002). Morales AV, Yasuda Y, Ish-Horowicz D.Dev Cell. 3(1):63-74.[ highlights in Current Biology 12 :R699-R701 (2002); The Scientist 16 (20) :45 (2002) and in Faculty of 1000, 2002.
Contacto
Dónde encontrarnos
Laboratorio de Control Molecular de la Neurogénesis
Instituto Cajal CSIC. Avda. Doctor Arce, 37. 28002. Madrid
Llámanos
Teléfono:
Escríbenos un mensaje
Correo electrónico:
Otros
Tesis Doctorales
- Cristina Medina Menéndez. Análisis del origen de la neurogenesis hippocampal adulta: control de la quiescencia de las células madre neurales por el factor de transcripción Sox5. Doctorado Biociencias Moleculares, UAM (13/04/2023, Sobresaliente cum laude).
- Lingling Li: «Role of Sox5 and Sox6 in adult hippocampal neurogenesis». Facultad de Ciencias, Universidad Autónoma de Madrid. (18/12/2020; Sobresaliente cum laude por unanimidad).
- Alejandra Quiroga del Río: «Función de Sox5 y Sox6 en el desarrollo del sistema nervioso de pez medaka».Facultad de Ciencias, Universidad Autónoma de Madrid. (22/03/2013; Sobresaliente cum laude por unanimidad; Mención europea).
- Patricia Martínez Morales: «Bases moleculares del desarrollo de la cresta neural troncal». Facultad de Ciencias, Universidad Autónoma de Madrid (25 de Febrero del 2011, Sobresaliente cum laude por unanimidad; Premio Extraordinario de Doctorado, Dept. Bioquímica, UAM).


Colaboraciones
- Liset Menéndez de la Prida (Instituto Cajal)
- José Luís Trejo (Instituto Cajal)
- Helena Mira Instituto de Biomedicina de Valencia, CSIC)
- Carlos Vicario Abejón (Instituto Cajal)
- Ana Martínez (Centro de Investigaciones Biológicas, CSIC)
- Victor Ruíz (Instituto de Investigaciones Biomédicas “Alberto Sols”, CSIC)
- Silvia Nicolis (University Milano Bicoca, Italy).
Financiación
- Análisis de la neurogénesis hipocampal durante el desarrollo y la etapa adulta a través del estudio funcional de los genes SoxD. MCINN SAF2017-85717-R (2018-2021)
- Análisis de la participación hipocampal en las interacciones sociales en un modelo genético de trastorno del espectro autista. Fundación Alicia Koplowitz (2018-2020)

Centro de investigación en neurociencias dependiente del CSIC. Fundado en 1920 y dirigido en sus inicios por Santiago Ramón y Cajal. Referente mundial en el estudio del cerebro. Depositario del Legado Cajal.
Actividades
