LABORATORIOS
Neurobiología de los ganglios basales
Neurobiología de los ganglios basales
Investigación
Personal
Publicaciones
Contacto
Otros
Investigación
Nuestro laboratorio tiene una amplia experiencia en la fisiología y patología de los ganglios basales, el sustrato neuroanatómico de la Enfermedad de Parkinson (EP) y otros desórdenes neurológicos como la drogadicción.
Estamos interesados en estudiar los mecanismos moleculares implicados en la degeneración dopaminérgica y las discinesias inducidas por L-DOPA. En particular, estudiamos los mecanismos responsables de la plasticidad estructural y sináptica de las neuronas estriatales de proyección en la EP y el papel que juegan los receptores dopaminérgicos. También estamos interesados en determinar las bases anatómicas y moleculares implicadas en el desarrollo de los síntomas no motores de la EP y los trastornos mentales derivados del tratamiento con L-DOPA e identificar los circuitos neuronales implicados, así como sus causas. El esclarecimiento de los mecanismos moleculares que subyacen a la fisiopatología de la EP es fundamental para desarrollar estrategias terapéuticas que puedan detener o decelerar la progresión de la enfermedad.
Para abordar estos objetivos, usamos metodologías sofisticadas como:
- Optogenética y farmacogenética
- Fibrometría
- Técnicas de electrofisiología in vivo e in vitro
- Técnicas de imagen
- Test de comportamiento
- Técnicas de inmunohistoquímica, inmunofluorescencia y biología molecular.
- Modelos animales transgénicos de la EP.
- Modelos celulares paciente-específicos de la EP.

Líneas de investigación
1) Plasticidad estructural y sináptica de los ganglios basales
La denervación dopaminérgica de las neuronas del estriado y la pérdida de las sinapsis axo-espinosas que transmiten la información motora de la sustancia negra (SN) son el sello distintivo de la EP. En el laboratorio estudiamos los mecanismos responsables de esta remodelación sináptica y cómo varía con el tratamiento de L-DOPA para producir discinesias. Hemos desarrollado estrategias para estudiar esta plasticidad en los dos tipos principales de neuronas estriatales que controlan el movimiento y su relación causal con la respuesta motora en la EP y en las discinesias.
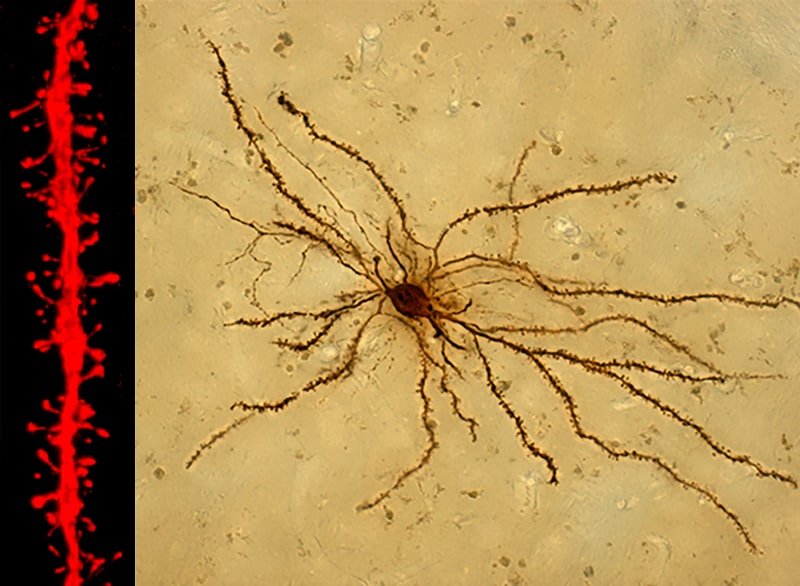
2) Trastorno del Control de Impulsos en la EP
Aunque la terapia de reemplazo de dopamina alivia los síntomas motores de la EP, con el tiempo, produce complicaciones incapacitantes. Además de las discinesias, esta terapia puede inducir el Trastorno del Control de Impulsos, una condición psiquiátrica que afecta a más del 13% de los pacientes y está caracterizada por la incapacidad para frenar los impulsos, dando lugar a conductas de riesgo como ludopatía, compras compulsivas o hipersexualidad. Para comprender este trastorno, utilizamos abordajes multidisciplinares combinando registros electrofisiológicos de los circuitos neuronales que procesan la información motivacional y de recompensa con técnicas de optogenética en modelos animales transgénicos de la EP.
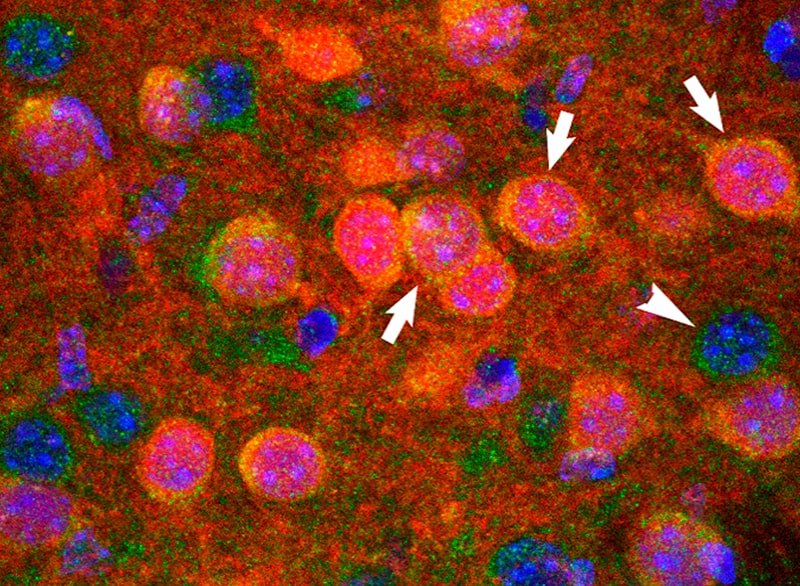
3) Síntomas no motores de la Enfermedad de Parkinson
Los síntomas no motores como la ansiedad/depresión y los trastornos gastrointestinales afectan, respectivamente, hasta el 50% y el 80% de los pacientes con EP. Estas alteraciones tempranas agravan la evolución de la enfermedad, afectando profundamente la calidad de vida de los pacientes. A pesar de que su presencia clínica en la EP se demostró hace varios años, la base subyacente sigue siendo desconocida. Utilizamos modelos animales de la EP y muestras cerebrales post-mortem de pacientes con EP para determinar los circuitos neuronales y bases moleculares que rigen el desarrollo de estos síntomas no motores.
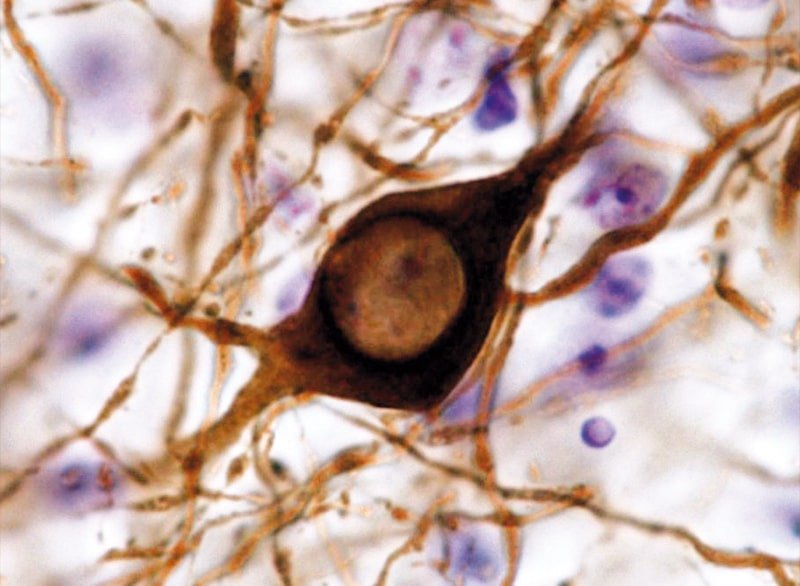
4) Bases neuropatológicas de la EP. Estrategias terapéuticas
La agregación de la proteína αSyn es la principal característica neuropatológica de la EP. Sin embargo, los mecanismos que determinan su agregación, así como la muerte neuronal dopaminérgica permanecen en gran parte desconocidos. Las mutaciones en el gen GBA1 constituyen el principal factor de riesgo genético de la EP y promueven la agregación de la αSyn. Para determinar las bases que rigen la neuropatología de la EP, usamos modelos animales de αSyn y fibroblastos derivados de pacientes parkinsonianos portadores de mutaciones en GBA1. Además, estamos evaluando el potencial terapéutico de diferentes estrategias diseñadas para detener la progresión de la EP.
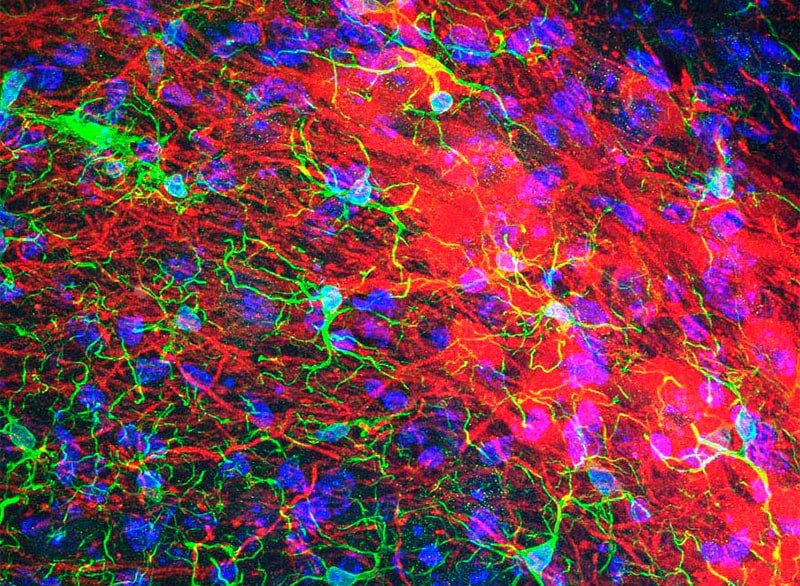
Personal

Rosario Moratalla Villalba
Responsable del grupo
Profesor de Investigación

Noelia Granado Martínez
Investigadora postdoctoral

Elena Juárez Escoto
Investigadora postdoctoral

Adrián Sanz Magro
Investigador postdoctoral

Juan Enríquez Traba
Investigador predoctoral

Mario García-Verdugo Jiménez-Egizabal
Investigador predoctoral

Mónica Gómez Benito
Investigadora predoctoral

Carlos Salas Prieto
Investigador predoctoral

Aida de la Fuente Murillo
Técnica de laboratorio

Sara Murillo Alonso
Técnica de laboratorio
Publicaciones
Publicaciones más relevantes
- Selective activation of striatal indirect pathway suppresses levodopa induced-dyskinesias. Castela I, Casado-Polanco R, Rubio YV, da Silva JA, Marquez R, Pro B, Moratalla R, Redgrave P, Costa RM, Obeso J, Hernandez LF. Neurobiol Dis. 2023 Jan;176:105930. doi: 10.1016/j.nbd.2022.105930
- Motor cortico-nigral and cortico-entopeduncular information transmission and its modulation by buspirone in control and after dopaminergic denervation. Vegas-Suárez S, Morera-Herreras T, Requejo C, Lafuente JV, Moratalla R, Miguélez C, Ugedo L. Front Pharmacol. 2022 Aug 30;13:953652. doi: 10.3389/fphar.2022.953652.
- Metabolic Diffusion in Neuropathologies: The Relevance of Brain-Liver Axis. Vegas-Suárez S, Simón J, Martínez-Chantar ML, Moratalla R. Front Physiol. 2022 May 12;13:864263. doi: 10.3389/fphys.2022.864263.
- Restricting feeding to dark phase fails to entrain circadian activity and energy expenditure oscillations in Pitx3-mutant Aphakia mice. Fernández-Pérez A, Sanz-Magro A, Moratalla R, Vallejo M. Cell Rep. 2022 Jan 11;38(2):110241. doi: 10.1016/j.celrep.2021.110241.
- Genetic deletion of dopamine D1 receptors increases the sensitivity to cannabinoid CB1 receptor antagonist-precipitated withdrawal when compared with wild-type littermates: studies in female mice repeatedly exposed to the Spice cannabinoid HU-210. Serrano A, Vadas E, Ferrer B, Bilbao A, Granado N, Suárez J, Pavon FJ, Moratalla R, Rodríguez de Fonseca F. Psychopharmacology (Berl). 2021 Feb;238(2):551-557. doi: 10.1007/s00213-020-05704-8. Epub 2021
- Dopamine DR2R is required for Hippocampal-dependent Memory and Plasticity at the CA2-CA1 Synapse. Espadas I, Ortiz O, García-Sanz P, Sanz-Magro A, Alberquilla S., Solis O, Delgado-García JM, Gruart A & Moratalla R. Cereb Cortex. 2021 Mar 5; 31(4): 2187-2204. doi:10.1093/cercor/bhaa354. PMID:33264389.
- The Role of Cholesterol in α-Synuclein and Lewy Body Pathology in GBA1 Parkinson’s Disease. García-Sanz, P., M F G Aerts, J., & Moratalla, R. Movement Disorders. 2020 Nov. doi: org/10.1002/mds.28396.
- Sex-specific behavioral and neurogenic responses to cocaine in mice lacking and blocking dopamine D1 or dopamine D2 receptors. Rivera, P., Aranda, J., Alén, F., Vargas, A., Serrano, A., Pavón, F. J., Orio, L., Rubio, L., Moratalla, R., de Fonseca, F. R., & Suárez, J. The Journal of comparative neurology. 2021. 529(8):1724-1742. doi: 10.1002/cne.25052.
- Diabetes Causes Dysfunctional Dopamine Neurotransmission Favoring Nigrostriatal Degeneration in Mice. Pérez-Taboada, I., Alberquilla, S., Martín, E. D., Anand, R., Vietti-Michelina, S., Tebeka, N. N., Cantley, J., Cragg, S. J., Moratalla, R., & Vallejo, M. Movement Disorders. 2020 Sep. 35(9):1636-1648. doi: 10.1002/mds.28124.
- Dopamine D1 Receptors Regulate Spines in Striatal Direct-Pathway and Indirect-Pathway Neurons. Suarez, L. M., Solis, O., Sanz-Magro, A., Alberquilla, S., & Moratalla, R. Movement Disorders. 2020 Oct. 35(10):1810-1821. doi: 10.1002/mds.28174.
- Modeling Parkinson disease with the alpha-synuclein protein. Gómez-Benito M, Granado N, García-Sanz P, Michel A, Dumoulin M, and Moratalla R. Front. Pharmacol. 2020 Apr. 11:356. doi: 10.3389/fphar.2020.00356.
- Beneficial effects of the phytocannabinoid Δ9-THCV in L-DOPA-induced dyskinesia in Parkinson’s disease. Espadas, I., Keifman, E., Palomo-Garo, C., Burgaz, S., García, C., Fernández-Ruiz, J., & Moratalla, R. Neurobiology of disease. 2020 Jul. 141:104892. doi: 10.1016/j.nbd.2020.104892.
- DRD3 (dopamine receptor D3) but not DRD2 activates autophagy through MTORC1 inhibition preserving protein synthesis. Barroso-Chinea, P., Luis-Ravelo, D., Fumagallo-Reading, F., Castro-Hernandez, J., Salas-Hernandez, J., Rodriguez-Nuñez, J., Febles-Casquero, A., Cruz-Muros, I., Afonso-Oramas, D., Abreu-Gonzalez, P., Moratalla, R., Millan, M. J., & Gonzalez-Hernandez, T. Autophagy. 2020 Jul. 16(7):1279-1295. doi: 1080/15548627.2019.1668606.
- Dopamine regulates spine density in striatal projection neurons in a concentration-dependent manner. Alberquilla S, Gonzalez-Granillo A, Martín ED, Moratalla R. Neurobiol. Dis. 2020 Feb. 134:104666. doi: 10.1016/j.nbd.2019.104666.
- A collection of three integration-free iPSCs derived from old male and female healthy subjects. Rodríguez-Traver E, Díaz-Guerra E, Rodríguez C, Arenas F, Orera M, Kulisevsky J, Moratalla R, and Vicario C. Stem Cell Res. 2020 Jan. 2:101663. doi: 10.1016/j.scr.2019.101663.
- Behavioral sensitization and cellular responses to psychostimulants are reduced in D2R knockout mice. Solís O, García-Sanz P, Martín AB, Granado N, Sanz-Magro A, Podlesniy P, Trullas R, Murer MG, Maldonado R, and Moratalla R. Addict Biol. 2019 Dec. 12:e12840. doi: 10.1111/adb.12840.
- Hypomorphic Expression of Pitx3 Disrupts Circadian Clocks and Prevents Metabolic Entrainment of Energy Expenditure. Del Río-Martín A, Pérez-Taboada I, Fernández-Pérez A, Moratalla R, de la Villa P, Vallejo M. Cell Rep. 2019 Dec. 29(11):3678-3692.e4. doi: 10.1016/j.celrep.2019.11.027.
- Generation of an integration-free iPSC line, ICCSICi005-A, derived from a Parkinson’s disease patient carrying the L444P mutation in the GBA1 gene. Rodríguez-Traver E, Rodríguez C, Díaz-Guerra E, Arenas F, Araúzo-Bravo M, Orera M, Kulisevsky J, Moratalla R, Vicario C. Stem Cell Res. 2019 Oct. 40:101578. doi: 10.1016/j.scr.2019.101578.
- DRD3 (dopamine receptor D3) but not DRD2 activates autophagy through MTORC1 inhibition preserving protein synthesis. Barroso-Chinea P, Luis-Ravelo D, Fumagallo-Reading F, Castro-Hernandez J, Salas-Hernandez J, Rodriguez-Nuñez J, Febles-Casquero A, Cruz-Muros I, Afonso-Oramas D, Abreu-Gonzalez P, Moratalla R, Millan MJ, Gonzalez-Hernandez T. Autophagy. 2019 Oct. 2:1-17. doi: 10.1080/15548627.2019.1668606.
- Changes in Dendritic Spine Density and Inhibitory Perisomatic Connectivity onto Medium Spiny Neurons in L-Dopa-Induced Dyskinesia. Gomez G, Escande MV, Suarez LM, Rela L, Belforte JE, Moratalla R, Murer MG, Gershanik OS, Taravini IRE. Mol Neurobiol. 2019 Sep. 56(9):6261-6275. doi: 10.1007/s12035-019-1515-4.
- A collection of integration-free iPSCs derived from Parkinson’s disease patients carrying mutations in the GBA1 gene. Rodríguez-Traver E, Díaz-Guerra E, Rodríguez C, Fernández P, Arenas F, Araúzo-Bravo M, Orera M, Kulisevsky J, Moratalla R, Vicario C. Stem Cell Res. 2019 Jul. 38:101482. doi: 10.1016/j.scr.2019.101482.
- Optostimulation of striatonigral terminals in substantia nigra induces dyskinesia that increases after L-DOPA in a mouse model of Parkinson’s disease. Keifman E, Ruiz-DeDiego I, Pafundo DE, Paz RM, Solís O, Murer MG, Moratalla R. Br J Pharmacol. 2019 Jul. 176(13):2146-2161. doi: 10.1111/bph.14663.
- Genetic Knockdown of mGluR5 in Striatal D1R-Containing Neurons Attenuates L-DOPA-Induced Dyskinesia in Aphakia Mice. García-Montes JR, Solís O, Enríquez-Traba J, Ruiz-DeDiego I, Drucker-Colín R, Moratalla R. Mol Neurobiol. 2019 Jun. 56(6):4037-4050. doi: 10.1007/s12035-018-1356-6.
- Genetic enhancement of Ras-ERK pathway does not aggravate L-DOPA-induced dyskinesia in mice but prevents the decrease induced by lovastatin. Ruiz-DeDiego I, Fasano S, Solís O, Garcia-Montes JR, Brea J, Loza MI, Brambilla R, Moratalla R. Sci Rep. 2018 Oct. 8(1):15381. doi: 10.1038/s41598-018-33713-3.
- Striatal Reinnervation Process after Acute Methamphetamine-Induced Dopaminergic Degeneration in Mice. Granado N, Ares-Santos S, Tizabi Y, Moratalla R. Neurotox Res. 2018 Oct. 34(3):627-639. doi: 10.1007/s12640-018-9925-z.
- Dopamine receptors: homomeric and heteromeric complexes in L-DOPA-induced dyskinesia. Solís O, Moratalla R. J Neural Transm (Vienna). 2018 Aug. 125(8):1187-1194. doi: 10.1007/s00702-018-1852-x.
- Differential Synaptic Remodeling by Dopamine in Direct and Indirect Striatal Projection Neurons in Pitx3-/- Mice, a Genetic Model of Parkinson’s Disease.
- Suarez LM, Alberquilla S, García-Montes JR, Moratalla R. J Neurosci. 2018 Apr.38(15):3619-3630. doi: 10.1523/JNEUROSCI.3184-17.2018.
- Cholesterol and multilamellar bodies: Lysosomal dysfunction in GBA-Parkinson disease. García-Sanz P, Orgaz L, Fuentes JM, Vicario C, Moratalla R. Autophagy. 2018. 14(4):717-718. doi: 10.1080/15548627.2018.1427396.
- The importance of cholesterol in Parkinson’s disease. García-Sanz P and Moratalla R. Movement Disorders. 2018 Feb. 33(2):343-344. doi: 10.1002/mds.27251.
Contacto
Dónde encontrarnos
Laboratorio de Neurobiología de los ganglios basales (Laboratorio B-01)
Instituto Cajal CSIC. Avda. Doctor Arce, 37. 28002. Madrid
Llámanos
Teléfono despacho / teléfono laboratorio
+34 915 854 705 / +34 915 854 726
Escríbenos un mensaje
Otros
Últimos proyectos nacionales concedidos (2018-2022)
- Molecular mechanisms of early non-motor symptoms in Parkinson’s disease: role of asyn accumulation, GBA and lipid metabolism. Ref: PID2019-111693RB-I00.
Entidad financiadora: Ministerio de Ciencia e Innovación.
01/01/2020-30/06/2023. Dotación: 366.630 €.
- Efecto de las mutaciones del gen glucocerebrosidasa-1 en neuronas derivadas de células iPS de enfermos de Parkinson. Rescate del fenotipo y trasplante celular. Área: Terapia celular en enfermedades neurodegenerativas. Entidad: Fundación Ramón Areces, IP: Carlos Vicario
02/03 2017-01/03/2020. Dotación: 120.000 €
- Estudio del consumo de metanfetamina en la adolescencia como factor de riesgo para la adición y la vulnerabilidad dopaminérgica en el adulto: papel de la glía y del glutamato Ref: PNSD 2016I033.
Entidad financiadora: Ministerio de Sanidad, Servicios Sociales e Igualdad y Plan Nacional Sobre Drogas.
01/01/2017-31/12/2019. Dotación: 68.943 €.
- Bases moleculares de la plasticidad sináptica estriatal en las disquinesias y el trastorno de control de impulsos inducidos por L-DOPA en la enfermedad de Parkinson. Ref: SAF2016-78207-R.
Entidad financiadora: Ministerio de Economía, Industria y Competitividad.
01/01/2017-31/12/2019. Dotación: 350.000 €.
- Potencial patológico de los astrocitos: Una nueva perspectiva en la enfermedad de Alzheimer. Ref: 2015-2/02, formado por 5 grupos de investigación.
Entidad financiadora: CIBERNED, Instituto de Salud Carlos III.
2016-2017. Dotación total 350.000 €, 70.000 € grupo R. Moratalla.
Coordinador: Joan Comella. Investigador principal: R. Moratalla.
Últimos proyectos internacionales concedidos (2018-2022)
- Comorbidity mechanisms of anxiety and Parkinson’s disease (AND-PD), grant agreement n° 848002. Entidad financiadora: Unión Europea, Programa: Horizon 2020, convocatoria: H2020-SC1-BHC-2018-2020
Coordinador del Proyecto: Rosario Moratalla
01/01/2020-30/06/2024 Dotación IP: 805.000 €
- Development of a new in vivo radiotracer for αsynuclein. PCIN-2015-098
Entidad financiadora: Unión Europea, ERANET Euronanomed, Ministerio de Economía y Competitividad.
01/10/2015-30/09/2019. Dotación: 115.000€.
Coordinador: Mireille Dumoulin. Investigador principal: R. Moratalla.
Últimas tesis doctorales 2017-2023
- Adrián Sanz Magro. Bases moleculares de la neurodegeneración catecolaminérgica y su relación con los síntomas de ansiedad y depresión en la enfermedad de Parkinson. Marzo 2023. Universidad Autónoma de Madrid. Sobresaliente Cum Laude.
- Samuel Alberquilla. Regulación dopaminérgica de la plasticidad estructural y sináptica de las neuronas estriatales de proyección. Diciembre 2022. Universidad Autónoma de Madrid. Sobresaliente Cum Laude.
- Ettel Keifman Mecanismos involucrados en la generación de discinesias inducidas por L-DOPA en un modelo experimental de la enfermedad de Parkinson Diciembre, 2019. Universidad Autónoma de Buenos Aires (Argentina). Sobresaliente Cum Laude
- Lorena Orgaz Gordillo Implicación de las mutaciones N370S y L444P en el gen GBA1 en la desregulación de la homeostasis celular y su relación con la enfermedad de Parkinson. 2019. Universidad Autónoma de Madrid. Sobresaliente Cum Laude.
- Óscar Solís Castrejón Efecto de la inactivación genética de los receptores dopaminérgicos D3 en el desarrollo y expresión de las disquinesias. Julio, 2017. Universidad Autónoma de Madrid. Sobresaliente Cum Laude. Premio Alberto Rábano 2018. Fundación Romanillos. (Premio que se otorga a la mejor tesis doctoral sobre neurociencias básicas y clínicas, neurología, neurocirugía, neuropatología, neurofisiología o psiquiatría, defendida en alguna Universidad Española durante 2017).
TFM y TFG (2019-2022)
- Iris del Val. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Biologia. Universidad Complutense de Madrid. Septiembre 2022.
- Cristina Gonzalez Dragado. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Medicina. Universidad Autónoma de Madrid. Septiembre 2022.
- Viktoriya Kaloyanova Karaivanova Cambios en la longitud y arborización dendrítica del estriado een el tratamiento con L-Dopa en eun modelo murino de la enfermedad de Parkinson. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Medicina. Universidad Autónoma de Madrid. Septiembre 2020
- Guiomar Rodríguez Periñan Alteraciones moleculares y funcionales inducidas por la agregación de α-sinucleína en el núcleo dorsal del rafe y su impacto en la actividad β-glucocerebrosidasa. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Medicina. Universidad Autónoma de Madrid. Septiembre 2020.
- Elena Torres Campos Impacto celular y funcional de la acumulación de α‐sinucleína en el locus coeruleus y su correlación con la ansiedad en el modelo Glong de la enfermedad de Parkinson. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Medicina. Universidad Autónoma de Madrid. Septiembre 2020.
- Iris Menéndez Fernández Impacto de la mutación L444P en el gen GBA1 en la integridad de la red mitocondrial y la distribución lisosomal en la enfermedad de Parkinson. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Biología. Universidad Complutense de Madrid. Octubre 2019.
- Mónica Gómez Benito Caracterización de los mecanismos moleculares de la Enfermedad de Parkinson tras la infección con AAV de α-sinucleína humana mutada en ratón. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Medicina. Universidad Autónoma de Madrid. Septiembre 2019.
- Marta Posada Gracia Alteración neuronal del núcleo dorsal del rafe en un modelo genético de la enfermedad de Parkinson. Trabajo Fin de Máster. Master en Bioquímica, Biología Molecular y Biomedicina. Facultad de Ciencias Químicas. Universidad Complutense de Madrid. Julio 2019.
- Irene Costa Laparra Estudio de la red mitocondrial y la autofagia en un modelo celular paciente-específico de la enfermedad de Alzheimer. Trabajo Fin de Máster. Master en Neurociencias. Facultad de Biología. Universidad Complutense de Madrid. Julio 2019.
Libros
-
Moratalla R., Sanz-Magro A., Granado N. (2021) Amino-Cupric-Silver (A-Cu-Ag) Staining to Detect Neuronal Degeneration in the Mouse Brain: The de Olmos Technique. In: Llorens J., Barenys M. (eds) Experimental Neurotoxicology Methods. Neuromethods, vol 172. Humana, New York, NY. https://doi.org/10.1007/978-1-0716-1637-6_1
-
Moratalla R, Solís O, Suarez LM. Morphological Plasticity in the Striatum Associated with Dopamine Dysfunction. Incluído en: Handbook of Basal Ganglia Structure and Function 2e. 2017. H Steiner and KY Tseng (Eds.), Elsevier Inc., San Diego: Academic Press. 755-770. ISBN: 9780128022061
-
Moratalla R, Ares-Santos S, Granado N. Neurotoxicity of Methamphetamine. Incluído en: Handbook of neurotoxicity. 2014. RM Kostrzewa (Ed.), Editorial Springer-Verlag, New York. 2207-2230. ISBN 978-1-4614-7458-6. DOI: 10.1007/978-1-4614-5836-4
-
Ares-Santos S, Granado N, Moratalla R. Neurobiology of Methamphetamine. Incluído en: Biological Research on Addiction: Comprehensive Addictive Behaviours and Disorders. 2013. Miller PM (Ed.), Elsevier Inc., San Diego: Academic Press. 579-591. ISBN: 9780123983350.
Docencia
-
Neurofisiopatología de la enfermedad de Parkinson. Máster en Neurociencias de la Universidad Complutense de Madrid.
-
Bases Neurobiológicas de la Adicción a Drogas. Máster en Neurociencias de la Universidad Autónoma de Madrid. Instituto Cajal, Madrid.
-
Neurobiología del envejecimiento cerebral y de las enfermedades del sistema nervioso. Máster en Neurociencias de la Universidad Autónoma de Madrid.

Centro de investigación en neurociencias dependiente del CSIC. Fundado en 1920 y dirigido en sus inicios por Santiago Ramón y Cajal. Referente mundial en el estudio del cerebro. Depositario del Legado Cajal.
Actividades
